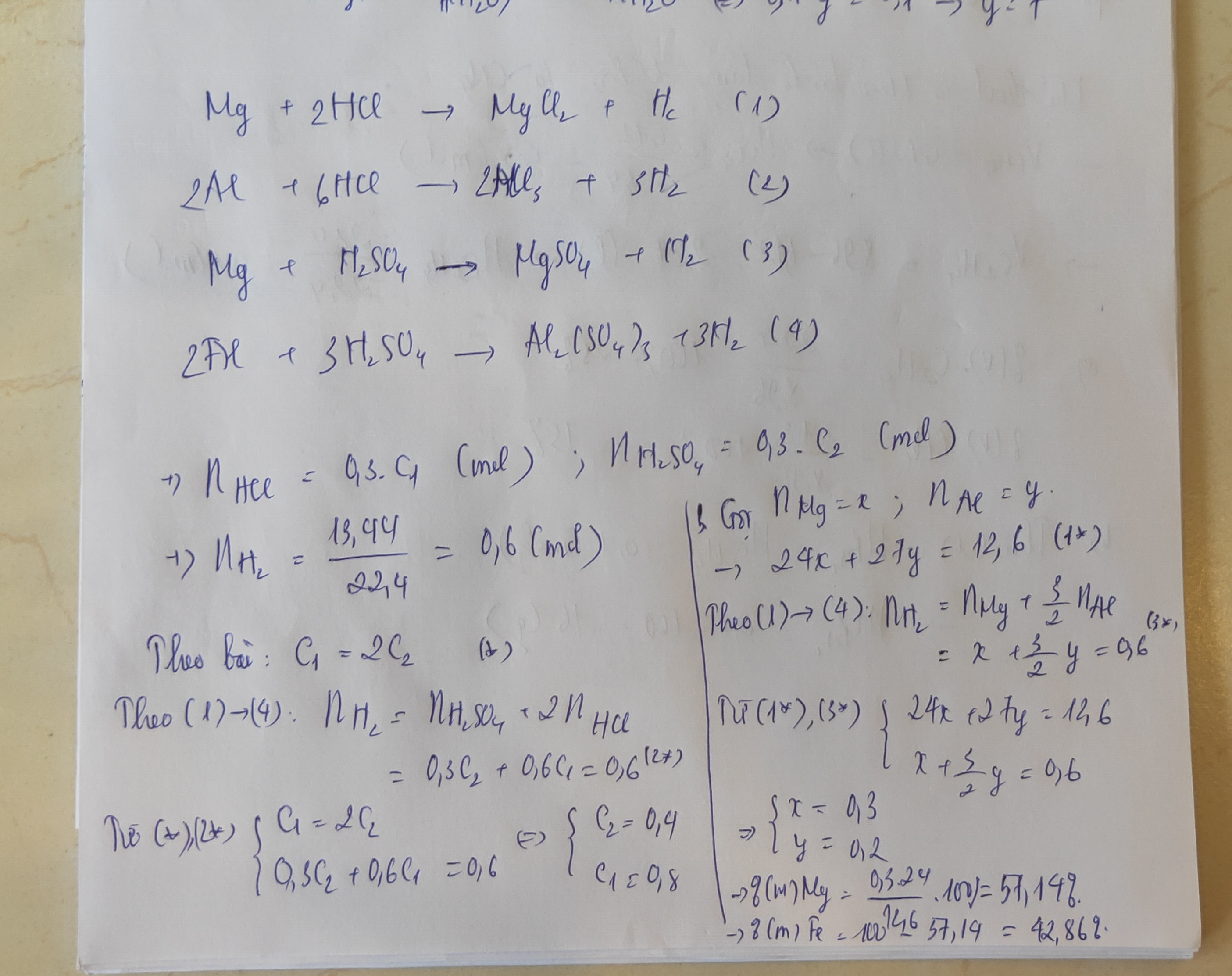Quảng cáo
2 câu trả lời 8166
Để giải bài toán này, ta cần thực hiện các bước sau:
Bước 1: Viết phương trình hóa học xảy ra giữa Mg và HCl:
Mg + 2HCl -> MgCl2 + H2
Bước 2: Viết phương trình hóa học xảy ra giữa Al và HCl:
2Al + 6HCl -> 2AlCl3 + 3H2
Bước 3: Viết phương trình hóa học xảy ra giữa Al2(SO4)3 và HCl:
Al2(SO4)3 + 6HCl -> 2AlCl3 + 3H2SO4
Bước 4: Tính số mol HCl trong dung dịch:
Với dung dịch HCl có nồng độ 1 mol/l và thể tích là 300 ml (0.3 l), ta có:
Số mol HCl = nồng độ x thể tích = 1 x 0.3 = 0.3 mol
Bước 5: Tính số mol Al2(SO4)3 trong dung dịch:
Với dung dịch Al2(SO4)3 có nồng độ 2 mol/l và thể tích là 0.3 l, ta có:
Số mol Al2(SO4)3 = nồng độ x thể tích = 2 x 0.3 = 0.6 mol
Bước 6: Từ số mol HCl và Al2(SO4)3, ta suy ra số mol Al và Mg trong hỗn hợp a:
Số mol Al = 2 x số mol Al2(SO4)3 = 2 x 0.6 = 1.2 mol
Số mol Mg = số mol HCl - số mol Al2(SO4)3 = 0.3 - 0.6 = -0.3 mol (do Mg không phản ứng với H2SO4)
Bước 7: Tính khối lượng của Al và Mg trong hỗn hợp a:
Khối lượng Al = số mol Al x khối lượng mol Al = 1.2 x 27 = 32.4 g
Khối lượng Mg = số mol Mg x khối lượng mol Mg = -0.3 x 24 = -7.2 g (khối lượng âm có nghĩa là không có Mg trong hỗn hợp)
Bước 8: Tính phần trăm về khối lượng của Al và Mg trong hỗn hợp a:
Phần trăm Al = (Khối lượng Al / Khối lượng hỗn hợp a) x 100% = (32.4 / 12.6) x 100% = 257.14%
Phần trăm Mg = (Khối lượng Mg / Khối lượng hỗn hợp a) x 100% = (-7.2 / 12.6) x 100% = -57.14%
Kết luận: Trong hỗn hợp a, phần trăm về khối lượng của Al là 257.14% và không có Mg.
Quảng cáo
Bạn cần hỏi gì?
Câu hỏi hot cùng chủ đề
-
 Đã trả lời bởi chuyên gia
45280
Đã trả lời bởi chuyên gia
45280 -
 Đã trả lời bởi chuyên gia
43334
Đã trả lời bởi chuyên gia
43334 -
Hỏi từ APP VIETJACK
 Đã trả lời bởi chuyên gia
39000
Đã trả lời bởi chuyên gia
39000 -
 Đã trả lời bởi chuyên gia
36812
Đã trả lời bởi chuyên gia
36812 -
 Đã trả lời bởi chuyên gia
34745
Đã trả lời bởi chuyên gia
34745 -
 Đã trả lời bởi chuyên gia
32120
Đã trả lời bởi chuyên gia
32120 -
Hỏi từ APP VIETJACK
 Đã trả lời bởi chuyên gia
31425
Đã trả lời bởi chuyên gia
31425