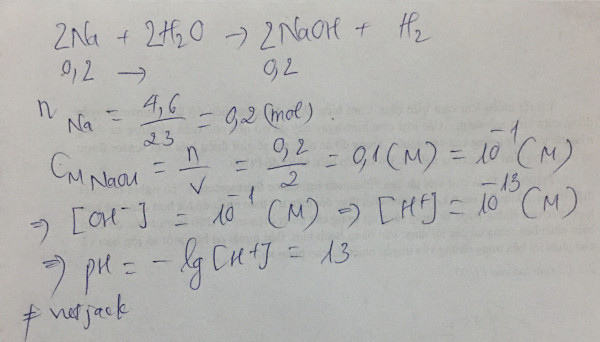Quảng cáo
2 câu trả lời 27467
Để tính pH của dung dịch thu được khi hòa tan 4,6 g Na vào nước, ta thực hiện các bước sau:
Bước 1: Tính số mol Na
Khối lượng mol của Na (Natri) là khoảng 23 g/mol.
Số mol Na được tính bằng công thức:
�=��n=Mm
Trong đó:
�=4,6 �m=4,6g
�=23 �/���M=23g/mol
Tính số mol:
�=4,623≈0,2 ���n=234,6≈0,2mol
Bước 2: Phản ứng giữa Na và nước
Phản ứng giữa Na và nước được mô tả như sau:2 ��+2 �2�→2 ����+�22Na+2H2O→2NaOH+H2
Từ phản ứng trên, 2 mol Na sẽ tạo ra 2 mol NaOH. Do đó, 0,2 mol Na sẽ tạo ra 0,2 mol NaOH.
Bước 3: Tính nồng độ NaOH trong dung dịch
Dung tích dung dịch thu được là 2 lít.
Nồng độ mol của NaOH được tính bằng công thức:
�=��C=Vn
Trong đó:
�=0,2 ���n=0,2mol
�=2 �V=2l
Tính nồng độ:
�=0,22=0,1 ���/�C=20,2=0,1mol/l
NaOH là một bazơ mạnh, hoàn toàn phân li trong nước:����→��++��−NaOH→Na++OH−
Nồng độ ion OH⁻ trong dung dịch là 0,1 mol/l.
Bước 5: Tính pOH và pH
Tính pOH:
���=−log[��−]=−log(0,1)=1pOH=−log[OH−]=−log(0,1)=1
Tính pH:
��+���=14 ⟹ ��=14−���=14−1=13pH+pOH=14⟹pH=14−pOH=14−1=13
Kết luận
pH của dung dịch thu được là 13.
Quảng cáo
Bạn cần hỏi gì?
Câu hỏi hot cùng chủ đề
-
 Đã trả lời bởi chuyên gia
100924
Đã trả lời bởi chuyên gia
100924 -
 Đã trả lời bởi chuyên gia
89518
Đã trả lời bởi chuyên gia
89518 -
 Đã trả lời bởi chuyên gia
68620
Đã trả lời bởi chuyên gia
68620 -
Hỏi từ APP VIETJACK64714
-
 Đã trả lời bởi chuyên gia
63714
Đã trả lời bởi chuyên gia
63714 -
 Đã trả lời bởi chuyên gia
54972
Đã trả lời bởi chuyên gia
54972 -
Hỏi từ APP VIETJACK44820
-
Hỏi từ APP VIETJACK
 Đã trả lời bởi chuyên gia
43103
Đã trả lời bởi chuyên gia
43103