tính thể tích ở 25C và 1 bar của 28g khí N2
Quảng cáo
2 câu trả lời 224
Để tính thể tích của 28g khí N2 ở nhiệt độ 25°C và áp suất 1 bar, ta làm như sau:
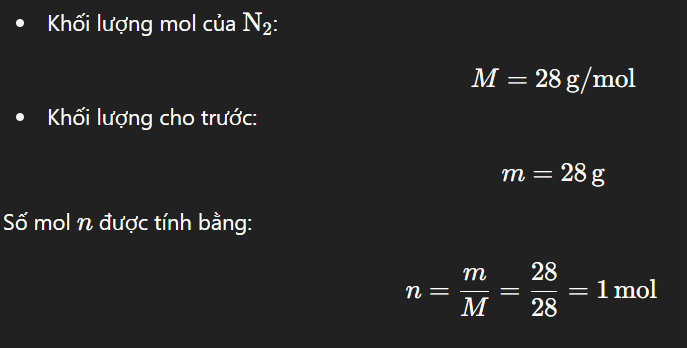
Ở điều kiện chuẩn (0°C, 1 atm), 1 mol khí lý tưởng chiếm thể tích 22,4 lít. Tuy nhiên, ở 25°C và 1 bar, ta cần dùng phương trình khí lý tưởng: PV = nRT
+ P = 1 bar = 105 Pa (có thể để 1 bar trực tiếp nếu dùng R thích hợp)
+ n = 1 mol
+ R = 0.08314 L.bar/(mol.K)
+ T = 25°C = 25 + 273 = 298K
+ n = 1 mol
+ R = 0.08314 L.bar/(mol.K)
+ T = 25°C = 25 + 273 = 298K
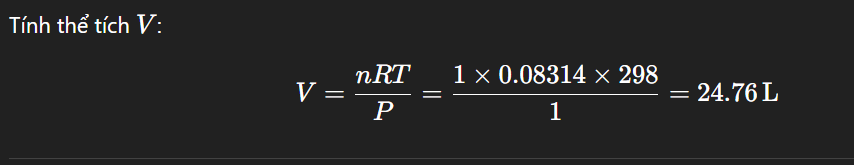
=> Thể tích của 28g khí N2 ở 25°C và 1 bar là khoảng 24.76 lít.
2 tháng trước
`n_(N_2) = 28/28 = 1` mol
`V_(N_2) = 1 xx 24,79 = 24,79` mol
Quảng cáo
Bạn muốn hỏi bài tập?
Câu hỏi hot cùng chủ đề
Gửi báo cáo thành công!


