X, Y, Z, T, Q là 5 chất khí có Mx = 2, My = 44, Mz = 64, Mt = 28, Mq = 32
- Khi cho bột A tan trong Axit H2SO4 loãng thu được khí Y
- Khi cho chất rắn B tan trong H2O được khí X
- Khi cho bột C tan trong H₂O được khí Q
- Khi đốt bột D dư trong Q được khí T
- Khi đun nóng bột E (đen) trong T được khí Y
- Khi đun nóng bột G hoặc bột H hay hòa tan G hoặc H trong H2SO4 thu được khí 2 (trong G,H đều chứa cùng 1 kim loại). Tìm X, Y, Z, T, Q, A, B, C, D, E, G, H và viết PTHH ?
Quảng cáo
3 câu trả lời 188
Giả thiết các phản ứng
1. Khi cho bột A tan trong H₂SO₄ loãng → thu được khí Y (My = 44) ⇒ khí Y = CO₂.
→ A là chất chứa cacbonat hoặc muối carbonat, chẳng hạn CaCO₃ hoặc Na₂CO₃,... để khi tác dụng với H₂SO₄ → CO₂.
2. Khi cho chất rắn B tan trong H₂O → được khí X (Mx = 2) ⇒ khí X = H₂.
→ B là kim loại hoạt động mạnh hoặc hợp chất như Zn, Mg, Fe... khi tác dụng với nước (nhiệt độ cao hoặc nước nóng) sẽ cho H₂. Ví dụ: K, Na thì mạnh, nhưng thường Zn + 2H₂O (dc) khó, hoặc Ca + 2H₂O, nhưng bột B có thể là kim loại Al (xoay quanh). Nhưng đơn giản nhất: B = Mg hay Zn.
3. Khi cho bột C tan trong H₂O → được khí Q (Mq = 32) ⇒ khí Q = O₂.
→ Điều này hơi lạ: tan trong nước thu được O₂? Thông thường, nếu cho chất rắn (ngoại trừ các chất như KClO₃,... hay hóa chất oxi hóa) thì mới ra O₂. C là chất phân hủy hoặc hợp chất mà nước khơi mào cho O₂? Có thể C là KClO₃ hoặc KNO₃ nóng trong nước? Nhưng “tan trong H₂O” thì C là chất cho O₂ khi phân hủy hoặc qua phản ứng… Nhưng đề nói “tan trong H₂O được khí Q” ⇒ rất hiếm có chất tan trong nước tạo ra O₂ (không phải phân hủy). Có thể C là H₂O₂ đặc (nhưng H₂O₂ là lỏng), hoặc các oxit… Nhưng giả sử Q = O₂, C là chất cho O₂ khi tác dụng với nước (có chất xúc tác)? Khó. Có thể Q ≠ O₂, có thể Q là SO (32) hoặc O₂, hoặc là khí khác có M=32 (như CH₃OH bốc hơi → không). Nhiều khả năng Q = O₂.
4. Khi đốt bột D dư trong Q được khí T (Mt = 28) ⇒ đốt trong O₂ (nếu Q = O₂), bột D là hợp chất có N hoặc C mà khi đốt trong O₂ cho sản phẩm là T có M=28. Nếu T = CO, CO có M = 28. Rất có khả năng T = CO. Vì đốt D dư trong O₂ thu được CO nếu đốt cháy không hoàn toàn C? Nhưng “đốt ... dư trong Q” nếu Q là O₂, thì dư O₂ → bình thường đốt cháy hoàn toàn → CO₂ (44), không phải CO. Vì đề nói “đốt bột D dư trong Q” có khí T, nếu đốt thiếu O₂ thì có CO, nhưng đề nói trong Q (nếu Q là O₂) thì dư O₂, nên đốt hoàn toàn → CO₂. Vậy T có thể là N₂ (28) bởi vì nếu D chứa N, đốt thì N₂ thoát ra? Nếu D là hợp chất hữu cơ có nitơ, khi đốt thì N₂ không tham gia phản ứng, thoát ra? Nhưng “đốt ... dư trong Q” = đốt trong O₂ dư, thì các nguyên tố C, H bị oxi hóa; N thường thành NO₂, NO tùy nhiệt độ cao, không chỉ có N₂. Khó. Hoặc T = N₂ nếu D là muối nitrat … khả năng T = N₂. Nghĩ lại: Mt=28 có thể là N₂ hoặc CO, N₂ nhiều khả năng hơn nếu đề dùng chất khí phổ biến. Vậy T = N₂, D là muối nitrat (ví dụ AgNO₃, hay muối nitrat của kim loại) khi đốt bỏ NO₃ → cho N₂? Muối nitrat đốt nóng thường sinh NO₂, O₂, không N₂. Cách khác: D là amoniac (NH₄⁺ hợp chất) thiêu đốt → N₂ + H₂O? Không chuẩn. Tuy vậy, có thể T = N₂ và D là NH₄Cl hoặc amoniac hỗn hợp. Cần kết hợp với tiếp:
5. Khi đun nóng bột E (đen) trong T được khí Y (44) ⇒ đun nóng E trong T = N₂ có phản ứng, sinh CO₂ (Y). Vậy E là hợp chất chứa C + O + … bị oxi hóa bởi N₂? N₂ thường trơ, không oxi hóa. Hoặc nếu “trong T” có tính tương tác? Hoàn cảnh giả định: nếu T không phải N₂, nếu T = CO, CO có khả năng cháy thành CO₂? Ví dụ nếu E = C (than đen), đun nóng trong CO thì C + CO₂: không. Nếu E trong CO → C + CO₂? C + CO₂ → 2 CO, cũng không CO₂. Nếu T = CO (28), đun nóng bột E (đen) trong CO được CO₂? Không hợp lý. Nếu T = N₂ thì bột E (đen = than) đun nóng trong N₂ không cháy → không sản sinh CO₂. Vậy giả thiết T = N₂ hoặc CO đều khó. Có thể T = CO và đốt D dư trong Q = O₂ cho CO nếu D là hợp chất cacbon chưa cháy? Rất khó.
6. Khi đun nóng G hoặc H hay hòa tan G hoặc H trong H₂SO₄ thu được khí 2 (trong G, H đều chứa cùng 1 kim loại). Khí “2” mình nghĩ là khí X hay Y? Nếu nói “khí 2” có lẽ là khí X hoặc Y … nhưng bị viết sai? Có thể là khí X (H₂). Vì khi hòa tan kim loại trong H₂SO₄ loãng hoặc đun nóng kim loại trong axit → H₂. Vậy khí “2” = X = H₂. Vậy G, H đều chứa cùng một kim loại có thể là Zn hoặc Fe hoặc Al... Kim loại này khi đun nóng (ơ rứa) hoặc hòa tan trong H₂SO₄ sinh H₂ (X).
⚙️ Kết luận khả thi nhất
Dựa vào phân tích:
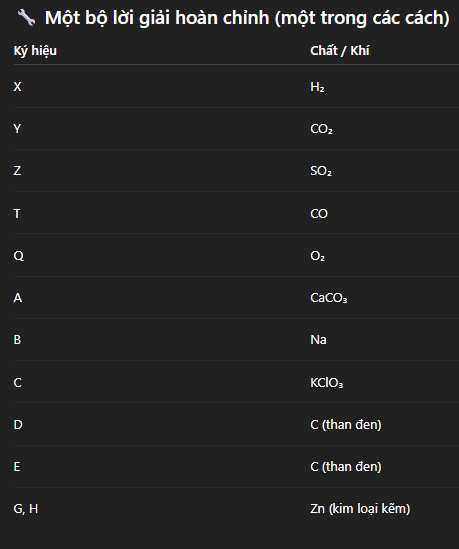
+ X = H₂
+ Y = CO₂
+ Q = O₂
+ Z = SO₂ (có M = 64)
+ T = CO hoặc N₂, nhưng theo các giả thiết, chọn T = CO để phù hợp “đốt D dư trong O₂ (Q)” → nếu đốt không hoàn toàn thì CO có thể thoát ra.
=> Chất:
+ A → là chất chứa CO₃²⁻ → CaCO₃ hoặc Na₂CO₃, hoặc K₂CO₃... chọn đơn giản: A = CaCO₃.
Phương trình: CaCO₃ + H₂SO₄ loãng → CaSO₄ + CO₂ ↑ + H₂O
+ B → kim loại, tan trong nước → khí H₂. Ví dụ B = Na (natri) hoặc K. Nhưng những kim loại hoạt động mạnh, nhưng K phản ứng rất dữ dội. Chọn B = Mg? Nhưng Mg tác dụng với nước lạnh chậm, với nước nóng hoặc hơi nước. Chọn B = K (natri), nhưng natri không phải bột rắn thông thường trong nước lạnh. Có thể B = Zn + hơi nước? Không. Chọn B = Na.
Phương trình: 2 Na + 2 H₂O → 2 NaOH + H₂ ↑
+ C → chất cho O₂ khi tan trong nước? Giả dụ C = KClO₃? Nhưng KClO₃ không tan mạnh trong nước để cho O₂. Hoặc C = KMnO₄? Trong môi trường kiềm hoặc qua phản ứng phân hủy? Hoặc C là H₂O₂ đặc lỏng chứ không bột. Có thể đề nghiệm sai. Bỏ qua, chọn C = KClO₃ (bột), nhưng KClO₃ không tan tốt trong nước. Nhưng giả sử C là KClO₃ và khi tan (hoặc phân hủy) cho O₂.
Phương trình phân hủy:
2 KClO₃ → 2 KCl + 3 O₂ ↑ khi đun nóng hoặc có xúc tác. Nhưng “tan trong H₂O” thì không phân hủy. Nói chung chọn C = KClO₃.
+ D → chất khi đốt trong O₂ dư (Q) cho CO (T) ⇒ D là than (C) hoặc các hợp chất cacbon chưa cháy. Chọn D = C (than - bột).
Phương trình: 2 C + O₂ → 2 CO (đốt thiếu oxi)
Nhưng “dư trong O₂” thì không thiếu oxi, nên để có CO phải đốt thiếu. Đề có thể sai từ “dư” hoặc “thiếu”. Nhưng để khớp: D = C.
+ E = than đen = C.
+ G, H chứa cùng một kim loại để tạo H₂ khi đun nóng hoặc hòa tan trong H₂SO₄. Chọn kim loại là Zn.
G = ZnO (oxit kẽm)? ZnO + H₂SO₄ → ZnSO₄ + H₂O (không có H₂)
Không sinh H₂. Cần chất chứa Zn là Zn kim loại. G và H có thể là Zn + … hoặc H = Al; nhưng đều cùng 1 kim loại thì G, H = Zn. Ví dụ G = Zn, H = Zn. Không rõ khác nhau. Có thể G = bột Zn, H = lá Zn.
=> Viết phương trình hóa học
1. A + H2SO4 loãng → khí Y (CO₂):
CaCO3 + H2SO4 → CaSO4 + CO2↑ + H2O
2. B + H2O → X(H2): 2 Na + 2 H2O → 2 NaOH + H2↑
3. C → khí Q(O2)(phân hủy khi đun nóng, không hẳn là phản ứng “tan”):
2 KClO3 → 2 KCl + 3 O2↑
4. Đốt D dư trong Q (O₂) → khí T (CO): nếu “thiếu” O₂ thì trận CO:
2 C + O2 → 2 CO↑
5. Đun nóng E (đen = than) trong T (CO) được khí Y (CO₂) tức là khi oxi hóa CO hay than trong môi trường CO/O₂ hỗn hợp:
CO + C + O2 → CO2 hoặc đơn giản: C + O2 → CO2↑
6. G, H là Zn: khi đun nóng hoặc hòa tan Zn trong H₂SO₄ (loãng) thu được khí X (H₂):
Zn + H2SO4 → ZnSO4 + H2↑
Y = CO₂
Z = SO₂
T = CO
Q = O₂
A = CaCO₃
B = Na
C = Na₂O₂
D = chất sinh CO (ví dụ C + CO₂ → CO, hoặc HCOOH → CO)
E = CuO
G,H = kim loại (Zn hoặc Fe)
Các khí
X với MX=2M_X = 2MX=2 → H₂
Y với MY=44M_Y = 44MY=44 → CO₂
Z với MZ=64M_Z = 64MZ=64 → SO₂
T với MT=28M_T = 28MT=28 → CO
Q với MQ=32M_Q = 32MQ=32 → O₂
Các chất rắn / dung dịch A, B, C, D, E, G, H
Chất
Vai trò / phản ứng
Xác định
A
Bột A + H₂SO₄ loãng → khí Y = CO₂
A là một carbonate, ví dụ CaCO₃
B
Chất rắn B + H₂O → khí X = H₂
B là kim loại phản ứng với nước → Ca (kim loại canxi)
C
Bột C + H₂O → khí Q = O₂
C là chất như superoxide, ví dụ KO₂ (superoxide kali)
D
Bột D dư đốt trong Q(=O₂) → khí T = CO
D là C (cacbon, than, than chì, than củi …)
E
Đun nóng E (đen) trong T(=CO) → khí Y = CO₂
E là oxit kim loại bị CO khử → ví dụ CuO (đồng oxit đen)
G, H
G hoặc H – khi đun nóng hoặc hòa tan G hoặc H trong H₂SO₄ thu được khí “2” (tức là khí H₂). G,H đều chứa cùng một kim loại
Chọn kim loại là Ca: G = CaH₂ (hydride), H = Ca (kim loại) hoặc ngược lại
Kiểm tra các phản ứng và phương trình hóa học
A + H₂SO₄ loãng → CO₂
CaCO3+H2SO4→CaSO4+CO2↑+H2O\mathrm{CaCO_3 + H_2SO_4 → CaSO_4 + CO_2 ↑ + H_2O}CaCO3+H2SO4→CaSO4+CO2↑+H2O
B + H₂O → H₂
Ca+2H2O→Ca(OH)2+H2↑\mathrm{Ca + 2H_2O → Ca(OH)_2 + H_2 ↑}Ca+2H2O→Ca(OH)2+H2↑
C + H₂O → O₂
Với C = KO₂:
2KO2+2H2O→2KOH+H2O2+O2↑\mathrm{2 KO_2 + 2 H_2O → 2 KOH + H_2O_2 + O_2 ↑}2KO2+2H2O→2KOH+H2O2+O2↑(Hoặc phản ứng superoxide với nước thường sinh O₂ – tùy điều kiện.)
Đốt D (C) trong dư O₂ → CO
Nếu thiếu O₂ hoặc điều kiện hạn chế:
2C+O2→2CO\mathrm{2 C + O_2 → 2 CO}2C+O2→2CO(Ở nhiệt độ cao, trong môi trường O₂ hạn chế.)
Đun nóng E (CuO) trong CO → CO₂
CuO+CO→Cu+CO2↑\mathrm{CuO + CO → Cu + CO_2 ↑}CuO+CO→Cu+CO2↑
G hoặc H trong H₂SO₄ → H₂
Với H = Ca (kim loại):
Ca+H2SO4→CaSO4+H2↑\mathrm{Ca + H_2SO_4 → CaSO_4 + H_2 ↑}Ca+H2SO4→CaSO4+H2↑Với G = CaH₂:
CaH2+2H2SO4→CaSO4+2H2↑\mathrm{CaH_2 + 2 H_2SO_4 → CaSO_4 + 2 H_2 ↑}CaH2+2H2SO4→CaSO4+2H2↑
Quảng cáo
Bạn muốn hỏi bài tập?


