Bộ 30 đề thi Giữa học kì 2 Hóa học lớp 10 Cánh diều có đáp án
Bộ 30 đề thi Giữa học kì 2 Hóa học lớp 10 Cánh diều có đáp án giúp học sinh ôn luyện để đạt điểm cao trong bài thi Hóa học 10 Giữa học kì 2. Mời các bạn cùng đón xem:
[Năm 2023] Đề thi Giữa học kì 2 Hóa học lớp 10 Cánh diều có đáp án
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa học kì 2
Năm học 2022 - 2023
Môn: Hóa học 10
Thời gian làm bài: 45 phút
Đề thi Giữa Học kì 2 Hóa học lớp 10 Cánh diều có đáp án - (Đề số 1)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Dấu hiệu để nhận biết một phản ứng oxi hóa – khử là dựa trên sự thay đổi đại lượng nào sau đây của nguyên tử?
A. Số hiệu nguyên tử.
B. Số mol.
C. Số khối.
D. Số oxi hóa.
Câu 2: Số oxi hóa của bromine trong HBr là
A. 0.
B. +1.
C. -1.
D. +2.
Câu 3: Phát biểu nào sau đây là đúng?
A. Trong các hợp chất số oxi hoá của hydrogen luôn là +1.
B. Trong các hợp chất số oxi hoá của oxygen luôn là -2.
C. Số oxi hoá của nhôm trong hợp chất là +3.
D. Trong một ion đa nguyên tử, tổng số số oxi hoá của nguyên tử bằng 0.
Câu 4: Số oxi hóa của lưu huỳnh (sulfur) trong SO42- là
A. +6.
B. +4.
C. -6.
D. -2.
Câu 5: Cho các hợp chất sau: NH3, NH4Cl, HNO3, NO2. Số hợp chất chứa nguyên tử nitrogen có số oxi hoá -3 là
A. 1.
B. 3.
C. 2.
D. 4.
Câu 6: Chất oxi hoá là chất
A. nhường electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
B. nhường electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
C. nhận electron, chứa nguyên tố có số oxi hóa tăng sau phản ứng.
D. nhận electron, chứa nguyên tố có số oxi hóa giảm sau phản ứng.
Câu 7: Trường hợp nào sau đây không xảy ra phản ứng oxi hoá – khử?
A. Đốt cháy than, củi để sưởi ấm.
B. Phản ứng quang hợp của cây xanh.
C. Nhỏ từ từ HCl vào dung dịch chứa NaOH.
D. Phản ứng tích trữ năng lượng của pin lithium – ion.
Câu 8: Dẫn khí CO đi qua ống sứ đựng bột CuO nung nóng để thực hiện phản ứng hóa học sau: CuO + CO Cu + CO2. Trong phản ứng trên, chất đóng vai trò chất khử là
A. CuO.
B. CO.
C. Cu.
D. CO2.
Câu 9: Cho các phản ứng hóa học sau:
(a) .
(b) .
(c) .
(d) .
Số phản ứng oxi hóa – khử là
A. 4.
B. 2.
C. 3.
D. 1.
Câu 10: Sục khí SO2 vào dung dịch KMnO4 (thuốc tím), màu tím nhạt dần rồi mất màu (biết sản phẩm tạo thành là MnSO4, H2SO4 và H2O). Nguyên nhân là do
A. SO2 đã oxi hóa KMnO4 thành MnO2.
B. SO2 đã khử KMnO4 thành Mn2+.
C. KMnO4 đã khử SO2 thành ![]() .
.
D. H2O đã oxi hóa KMnO4 thành Mn2+.
Câu 11: Trong giai đoạn đầu sản xuất nitric acid từ ammonia. Ammonia bị oxi hóa bởi oxygen ở nhiệt độ cao khi có chất xúc tác.
Tổng hệ số cân bằng (là các số nguyên, tối giản) của phản ứng là
A. 18.
B. 19.
C. 20.
D. 21.
Câu 12: Cho phản ứng sau:
Tổng hệ số cân bằng (là các số nguyên, tối giản) của phản ứng là
A. 15.
B. 16.
C. 17.
D. 18.
Câu 13: Dưới tác dụng của các chất xúc tác, glucose lên men tạo thành ethanol:
C6H12O6 2C2H5OH + 2CO2 (1)
Ethanol sinh ra lên men thành acetic acid:
C2H5OH + O2 CH3COOH + H2O (2)
Giả sử hiệu suất cả quá trình là 60%. Lượng glucose cần dùng để thu được 1 lít acetic acid 1M là
A. 150 gam.
B. 180 gam.
D. 240 gam.
D. 210 gam.
Câu 14: Cho 2,34 gam kim loại M (có hóa trị không đổi là n) tác dụng với dung dịch H2SO4 (đặc nóng, dư) thu được 3,2227 L SO2 (điều kiện chuẩn). Kim loại M là
A. Mg.
B. Fe.
C. Al.
D. Cu.
Câu 15: Phản ứng thu nhiệt là
A. phản ứng giải phóng năng lượng dưới dạng nhiệt.
B. phản ứng hấp thụ năng lượng dưới dạng nhiệt.
C. phản ứng giải phóng ion dưới dạng nhiệt.
D. phản ứng hấp thụ ion dưới dạng nhiệt.
Câu 16: Phản ứng nảo sau đây là phản ứng tỏa nhiệt?
A. Phản ứng nung vôi.
B. Phản ứng phân huỷ thuốc tím.
C. Phản ứng đốt cháy cồn (ethanol).
D. Phản ứng nung NH4Cl(s) tạo ra NH3(g) và HCl(g).
Câu 17: Khi nung vôi, người ta sử dụng phản ứng đốt than để cung cấp nhiệt cho phản ứng phân hủy đá vôi. Phát biểu nào sau đây là đúng?
A. Phản ứng đốt than là phản ứng thu nhiệt, phản ứng phân hủy đá vôi là phản ứng tỏa nhiệt.
B. Phản ứng đốt than là phản ứng tỏa nhiệt, phản ứng phân hủy đá vôi là phản ứng thu nhiệt.
C. Phản ứng đốt than và phản ứng phân hủy đá vôi là phản ứng tỏa nhiệt.
D. Phản ứng đốt than và phản ứng phân hủy đá vôi là phản ứng thu nhiệt.
Câu 18: Cho phản ứng sau:
H2(g) + Cl2(g) ® 2HCl (g)
Phản ứng này là
A. phản ứng thu nhiệt.
B. phản ứng tỏa nhiệt.
C. phản ứng thế.
D. phản ứng phân hủy.
Câu 19: Cho các phát biểu sau:
(1). Tất cả các phản ứng cháy đều thu nhiệt.
(2). Phản ứng toả nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
(3). Tất cả các phản ứng mà chất tham gia có chứa nguyên tố oxygen đều toả nhiệt.
(4). Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt.
Số phát biểu sai là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 20: Cho phản ứng sau:
CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g)
Biến thiên enthalpy chuẩn của phản ứng trên tính theo năng lượng liên kết là
A.
B.
C.
D.
Câu 21: Cho giản đồ năng lượng của các phản ứng 1 – 5 như sau:
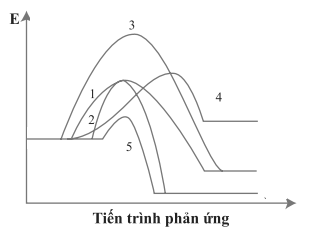
Số phản ứng toả nhiệt là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 22: Ở nhiệt độ 25oC và áp suất 1 bar, trong số các đơn chất halogen sau, đơn chất có enthalpy tạo thành chuẩn khác 0 là
A. F2(g).
B. I2(g).
C. Br2(l).
D. Cl2(g).
Câu 23: Ở điều kiện chuẩn, phản ứng có biến thiên enthalpy của phản ứng bằng enthalpy tạo thành của chất sản phẩm là
A. HCl(aq) + NaOH(aq) → NaCl(aq) + H2O.
B. N2(l) + 3F2(g) → 2NF3(g).
C. H2(g) + O2(g) → H2O2(g).
D.
Câu 24: Cho phản ứng sau:
2CO(g) + O2(g) → 2CO2(g)
Biết (kJ mol-1) của CO(g) và CO2(g) lần lượt là –110,53 và –393,51. Lượng nhiệt giải phóng khi chuyển 56 gam khí CO thành khí CO2 là
A. 565,96 kJ.
B. 424,47 kJ.
C. 282,98 kJ.
D. 106,11 kJ.
Câu 25: Cho phản ứng sau:
2NaCl(s) → 2Na(s) + Cl2(g)
Biết (kJ mol-1) của NaCl là –411,2. Trong quá trình nấu ăn, dù bị đun nóng nhưng muối ăn không bị phân hủy thành khí Cl2 độc, vì
A. rất dương, phản ứng không thuận lợi xảy ra.
B. rất âm, phản ứng không thuận lợi xảy ra.
C. phản ứng trên là phản ứng tỏa nhiệt.
D. phản ứng trên là phản ứng thu nhiệt.
Câu 26: Cho phản ứng tổng hợp ammonia (NH3) như sau:
N2(g) + 3H2(g) → 2NH3(g)
Biết năng lượng liên kết (kJ/mol) của N≡N và H–H lần lượt là 946 và 436. Năng lượng liên kết của N–H trong ammonia là
A. 391 kJ/mol.
B. 361 kJ/mol.
C. 245 kJ/mol.
D. 490 kJ/mol.
Câu 27: Cho phản ứng: C3H8(g) ⟶ CH4(g) + C2H4(g).
Giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn được cho ở bảng sau:
|
Liên kết |
C – H |
C – C |
C = C |
|
Eb (kJ/mol) |
418 |
346 |
612 |
Nhận xét nào sau đây là sai?
A. Phản ứng thu nhiệt.
B. Nhiệt lượng thu vào của phản ứng ở điều kiện chuẩn là 80kJ.
C. Liên kết C = C bền hơn liên kết C – C.
D. Nhiệt lượng toả ra của phản ứng ở điều kiện chuẩn là 80 kJ.
Câu 28: Cho phản ứng: N2(g) + O2(g) → 2NO(g). Biết năng lượng liên kết trong các phân tử O2, N2 và NO lần lượt là 494 kJ/mol, 945 kJ/mol và 607 kJ/mol. Phát biểu đúng là
A. Phản ứng toả nhiệt.
B. Nhiệt lượng thu vào của phản ứng là 25 kJ.
C. Phản ứng xảy ra ở ngay điều kiện thường.
D. Phản ứng xảy ra ở nhiệt độ cao hoặc khi có tia lửa điện.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Cân bằng các phản ứng sau bằng phương pháp thăng bằng electron, nêu rõ chất oxi hóa, chất khử, quá trình oxi hoá, quá trình khử:
a) HI + H2SO4 → SO2 + I2 + H2O.
b) Al + HNO3 → Al(NO3)3 + NH4NO3 + H2O.
Câu 2 (1 điểm): Tính lượng nhiệt tỏa ra ở điều kiện chuẩn khi đốt cháy 2 gam butane (C4H10) chứa trong một chiếc bật lửa gas. Biết sản phẩm của sự đốt cháy là khí carbon dioxide và hơi nước.
Cho của C4H10 (g), CO2 (g) và H2O (l) lần lượt là –126,15 kJ mol-1, –393,51 kJ mol-1 và –285,83 kJ mol-1.
Câu 3 (1 điểm): Quá trình đốt cháy ethanol diễn ra theo phản ứng:
C2H5OH (l) + 3O2 (g) → 2CO2 (g) + 3H2O (l)
Tính của phản ứng trên từ các giá trị năng lượng liên kết sau:
EC–C = 347 kJ mol-1; EO=O = 496 kJ mol-1; EC–O = 336 kJ mol-1; EC–H = 410 kJ mol-1; EC=O = 805 kJ mol-1; EO–H = 465 kJ mol-1.
Đáp án đề thi Giữa học kì 2 môn Hóa học lớp 10 Cánh diều - Đề số 1
Phần I: Trắc nghiệm
|
1 - D |
2 - C |
3 - C |
4 - A |
5 - C |
6 - D |
7 - C |
8 - B |
9 - D |
10 - B |
|
11 - B |
12 - C |
13 - A |
14 - C |
15 - B |
16 - C |
17 - B |
18 - B |
19 - B |
20 - C |
|
21 - D |
22 - B |
23 - C |
24 - A |
25 - A |
26 - A |
27 - D |
28 - D |
|
|
Câu 4:
Số oxi hóa của O là -2; gọi số oxi hóa của S là x, ta có:
x + 4. (-2) = -2 ⇒ x = +6.
Câu 11:
Ta có:
Phương trình hóa học đã được cân bằng như sau:
Tổng hệ số cân bằng (là các số nguyên, tối giản) của phản ứng là: 4 + 5 + 4 + 6 = 19.
Câu 12:
Ta có:
Phương trình đã được cân bằng như sau:
Tổng hệ số khi cân bằng các chất là 17.
Câu 13:
Từ các phương trình hóa học (1) và (2)
Do hiệu suất cả quá trình là 60% nên:
Câu 14:
Ta có các quá trình:
Vậy n = 3, M = 27, kim loại M là Al thỏa mãn.
Câu 24:
nCO = 2 mol.
Vậy lượng nhiệt giải phóng khi tạo 2 mol CO chính bằng :
= |2. (–393,51) – 2. (–110,53)| = 565,96 kJ.
Câu 25:
= –2.= –2. (–411,2) = 822,4 kJ.
rất dương nên phản ứng không thuận lợi xảy ra.
Câu 26:
Ta có: = EN≡N + 3.EH–H – 6.EN–H
Þ
Câu 27:
= 2.346 + 8.418 - 1.612 - 8.418 = +80 kJ.
Phản ứng là thu nhiệt do
Þ Phát biểu D sai.
Câu 28:
N2(g) + O2(g) → 2NO(g)
= (945.1 + 494.1) – 607.2 = 225 (kJ).
> 0, phản ứng thu nhiệt.
Tức là 1 mol N2 (g) phản ứng với 1 mol O2 (g) cần cung cấp 225kJ nhiệt lượng
⇒ Nitrogen chỉ phản ứng với oxygen ở nhiệt độ cao hoặc khi có tia lửa điện.
Phần II: Tự luận
Câu 1:
a)
Chất khử: HI; Chất oxi hoá: H2SO4.
Ta có các quá trình:
Phương trình hoá học:
2HI + H2SO4 → SO2 + I2 + 2H2O
b)
Chất khử: Al; Chất oxi hoá: HNO3.
Ta có các quá trình:
Phương trình hoá học:
8Al + 30HNO3 → 8Al(NO3)3 + 3NH4NO3 + 9H2O
Câu 2:
Phản ứng đốt cháy butane:
C4H10 (g) + O2 (g) → 4CO2 (g) + 5H2O (l)
= 4.+ 5. –
= 4.(–393,51) + 5.(–285,83) – (–126,15)
= –2877,04 kJ
= = mol
Lượng nhiệt tỏa ra ở điều kiện chuẩn khi đốt cháy 2 gam butane có giá trị là:
Qtỏa =.(–2877,04) = –99,21 kJ.
Câu 3:
Các liên kết trong C2H5OH gồm: 5 liên kết C-H, 1 liên kết C-C, 1 liên kết C-O và 1 liên kết O-H.
Ta có:
= ΣEb (cđ) – ΣEb (sp)
= (5.EC–H + EC–C + EC–O + EO–H + 3.EO=O) – (4.EC=O + 6.EO–H)
= (5.410 + 347 + 336 + 465 + 3.496) – (4.805 + 6.465)
= –1324 kJ.
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa học kì 2
Năm học 2022 - 2023
Môn: Hóa học 10
Thời gian làm bài: 45 phút
Đề thi Giữa Học kì 2 Hóa học lớp 10 Cánh diều có đáp án - (Đề số 2)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Trong phản ứng oxi hoá – khử, chất nhường electron được gọi là
A. chất khử.
B. chất oxi hoá.
C. acid.
D. base.
Câu 2: Trong hợp chất H2S, số oxi hóa của sulfur (lưu huỳnh) là
A. +2.
B. +3.
C. +5.
D. -2.
Câu 3: Nhận xét nào sau đây về số oxi hoá là không đúng?
A. Số oxi hoá của một nguyên tử nguyên tố trong hợp chất là điện tích của nguyên tử nguyên tố đó với giả định đây là hợp chất ion.
B. Số oxi hoá của nguyên tử nguyên tố trong đơn chất bằng 0.
C. Số oxi hoá của oxygen luôn là -2.
D. Số oxi hoá của các kim loại kiềm trong hợp chất luôn là +1.
Câu 4: Số oxi hóa của nitrogen trong NO3- là
A. +6.
B. +5.
C. +4.
D. +3.
Câu 5: Cho phản ứng: SO2 + Br2 + H2O → HBr + H2SO4. Trong phản ứng trên, vai trò của Br2
A. là chất oxi hóa
B. là chất khử.
C. vừa là chất oxi hóa, vừa là chất tạo môi trường.
D. vừa là chất khử, vừa là chất tạo môi trường.
Câu 6: Số oxi hoá của Al trong NaAlH4 là
A. +2.
B. +3.
C. -3.
D. +5.
Câu 7: Chlorine vừa đóng vai trò chất oxi hóa, vừa đóng vai trò chất khử trong phản ứng nào sau đây?
A. .
B. .
C. .
D. .
Câu 8: Trong các phản ứng hoá học sau, phản ứng oxi hoá – khử là
A. Ca(OH)2 + CuCl2 → Cu(OH)2↓ + CaCl2
B. Ca + Cl2 → CaCl2.
C. 3CaCl2 + 2K3PO4 → Ca3(PO4)2 + 6KCl.
D. CaO + 2HCl → CaCl2 + H2O.
Câu 9: Nhóm nào sau đây gồm các chất vừa có tính oxi hoá, vừa có tính khử?
A. Cl2, Al.
B. K, FeO.
C. H2SO4, F2.
D. SO2, FeO.
Câu 10: Trong phản ứng tạo thành magnesium chloride từ đơn chất: Mg + Cl2 → MgCl2.
Kết luận nào sau đây đúng?
A. Mỗi nguyên tử magnesium nhận 2e.
B. Mỗi nguyên tử chlorine nhận 2e.
C. Mỗi phân tử chlorine nhường 2e.
D. Mỗi nguyên tử magnesium nhường 2e.
Câu 11: Cho phản ứng: FeO + HNO3 ® Fe(NO3)3 + NO + H2O. Trong phản ứng này có bao nhiêu phân tử HNO3 đóng vai trò là chất oxi hóa?
A. 1.
B. 4.
C. 8.
D. 10.
Câu 12: Copper(II) oxide (CuO) bị khử bởi ammonia (NH3) theo phản ứng sau:
Tổng hệ số cân bằng (là số nguyên, tối giản) của chất tham gia phản ứng là
A. 5.
B. 12.
C. 13.
D. 14.
Câu 13: Cho phương trình hóa học:
aZn + bH2SO4 (đặc) cZnSO4 + dH2S + fH2O.
Giá trị của b trong phương trình hóa học trên là
A. 5.
B. 4.
C. 3.
D. 2.
Câu 14: Cho 8,4 gam Fe phản ứng hoàn toàn với lượng dư dung dịch HNO3, thể tích khí NO (đkc) thu được là (coi NO là sản phẩm khử duy nhất)
A. 2,2400 lít.
B. 3,3600 lít.
C. 3,7185 lít .
D. 5,6360 lít.
Câu 15: Cho các phản ứng sau:
(1) Phản ứng trung hoà acid – base: HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l).
(2) Phản ứng nung vôi: CaCO3(s) → CaO(s) + CO2(g).
Nhận xét nào sau đây là đúng?
A. Cả hai phản ứng đều toả nhiệt.
B. Cả hai phản ứng đều thu nhiệt.
C. Phản ứng (1) thu nhiệt, phản ứng (2) toả nhiệt.
D. Phản ứng (1) toả nhiệt, phản ứng (2) thu nhiệt.
Câu 16: Những ngày nóng nực, pha viên sủi vitamin C vào nước để giải khát, khi viên sủi tan, thấy nước trong cốc mát hơn đó là do
A. xảy ra phản ứng tỏa nhiệt.
B. xảy ra phản ứng thu nhiệt.
C. xảy ra phản ứng trao đổi chất với môi trường.
D. có sự giải phóng nhiệt lượng ra ngoài môi trường.
Câu 17: Phát biểu nào sau đây không đúng?
A. Các phản ứng cháy thường là phản ứng tỏa nhiệt.
B. Phản ứng càng tỏa ra nhiều nhiệt càng dễ tự xảy ra.
C. Các phản ứng phân hủy thường là phản ứng thu nhiệt.
D. Các phản ứng khi đun nóng đều dễ xảy ra hơn.
Câu 18: Ở điều kiện chuẩn. Khi phản ứng thu nhiệt thì
A. .
B. .
C. .
D. .
Câu 19: Enthalpy tạo thành chuẩn của một đơn chất bền là
A. biến thiên enthalpy chuẩn của phản ứng giữa đơn chất đó với hydrogen.
B. là biến thiên enthalpy chuẩn của phản ứng giữa đơn chất đó với oxygen.
C. bằng 0.
D. được xác định từ nhiệt độ nóng chảy của nguyên tố đó.
Câu 20: Biết phản ứng đốt cháy khí carbon monoxide (CO) như sau:
CO (g) + ![]() O2 (g) ⟶ CO2 (g)
O2 (g) ⟶ CO2 (g)
Ở điều kiện chuẩn, nếu đốt cháy hoàn toàn 2,479 L khí CO thì nhiệt lượng toả ra là bao nhiêu?
A. 283 kJ.
B. 28,3 kJ.
C. -283 kJ.
D. -28,3 kJ.
Câu 21: Phản ứng chuyển hoá giữa hai dạng đơn chất của phosphorus (P):
P (s, đỏ) ⟶ P (s, trắng) = 17,6 kJ
Điều này chứng tỏ phản ứng:
A. thu nhiệt, P đỏ bền hơn P trắng.
B. thu nhiệt, P trắng bền hơn P đỏ.
C. toả nhiệt, P đỏ bền hơn P trắng.
D. toả nhiệt, P trắng bền hơn P đỏ.
Câu 22: Xét phản ứng đốt cháy methane:
CH4(g) + 2O2(g) ⟶ CO2(g) + 2H2O(l) = – 890,3 kJ
Biết nhiệt tạo thành chuẩn của CO2(g) và H2O(l) tương ứng là – 393,5 và – 285,8 kJ/mol. Nhiệt tạo thành chuẩn của khí methane là
A. – 74,8 kJ.
B. 74,8 kJ.
C. – 211,6 kJ.
D. 211,6 kJ.
Câu 23: Cho phản ứng hóa học xảy ra ở điều kiện chuẩn sau:
2NO2(g) (đỏ nâu) → N2O4(g) (không màu)
Biết NO2 và N2O4 có tương ứng là 33,18 kJ/mol và 9,16 kJ/mol. Điều này chứng tỏ phản ứng
A. tỏa nhiệt, N2O4 bền vững hơn NO2.
B. thu nhiệt, N2O4 bền vững hơn NO2.
C. tỏa nhiệt, NO2 bền vững hơn N2O4.
D. thu nhiệt, NO2 bền vững hơn N2O4.
Câu 24: Cho phản ứng hydrogen hóa ethylene sau:
H2C=CH2(g) + H2(g) → H3C-CH3(g)
Biết năng lượng trung bình các liên kết trong các chất cho trong bảng sau:
|
Liên kết |
Eb (kJ/mol) |
Liên kết |
Eb (kJ/mol) |
|
C=C |
612 |
C-C |
346 |
|
C-H |
418 |
H-H |
436 |
Biến thiên enthalpy (kJ) của phản ứng có giá trị là
A. 134.
B. -134.
C. 478.
D. 284.
Câu 25: Công thức tính biến thiên enthalpy của phản ứng theo năng lượng liên kết là
A.
B.
C.
D.
Câu 26: Cho phản ứng sau:
= - 105 kJ
Biết ở điều kiện chuẩn: Eb(Cl-Cl) = 243 kJ/mol; Eb(C-Cl) = 339 kJ/mol; Eb(C=O) = 745 kJ/mol. Giá trị Eb(C ≡ O) là
A. 1075 kJ/ mol.
B. 105 kJ/ mol.
C. 150 kJ/ mol.
D. 107,5 kJ/ mol.
Câu 27: Phát biểu nào sau đây về nhiệt tạo thành là không đúng?
A. Enthalpy tạo thành chuẩn của một chất là lượng nhiệt kèm theo của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền nhất trong điều kiện chuẩn.
B. Nhiệt tạo thành chuẩn là nhiệt tạo thành ở điều kiện chuẩn.
C. Enthalpy tạo thành chuẩn của các đơn chất ở dạng bền vững nhất bằng 0.
D. Kí hiệu nhiệt tạo thành chuẩn là
Câu 28: Điều kiện nào sau đây không phải là điều kiện chuẩn?
A. Áp suất 1 bar và nhiệt độ 25oC hay 298K.
B. Áp suất 1 bar và nhiệt độ 298K.
C. Áp suất 1 bar và nhiệt độ 25K.
D. Áp suất 1 bar và nhiệt độ 25oC.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Dẫn khí SO2 vào 100 mL dung dịch KMnO4 0,02M đến khi dung dịch vừa mất màu tím.
Phản ứng xảy ra theo sơ đồ sau:
SO2 + KMnO4 + H2O → H2SO4 + K2SO4 + MnSO4
a) Lập phương trình hóa học của phản ứng theo phương pháp thăng bằng electron và chỉ rõ chất khử, chất oxi hoá.
b) Xác định thể tích khí SO2 đã tham gia phản ứng ở điều kiện chuẩn.
Câu 2 (1 điểm): Cho enthalpy tạo thành chuẩn của các chất sau:
|
Chất |
H2O2(l) |
H2O(l) |
O2(g) |
|
(kJ/ mol) |
- 187,6 |
-285,8 |
0 |
Giải thích tại sao ở điều kiện chuẩn, H2O2(l) kém bền, dễ dàng phân huỷ thành H2O(l) và O2(g). Ngược lại, H2O(l) lại rất bền trong tự nhiên.
Câu 3 (1 điểm): Ammonia thường được tổng hợp từ nitrogen và hydrogen bằng quy trình Haber – Bosch:
N2 (g) + 3H2 (g) 2NH3 (g)
a) Biết các giá trị năng lượng liên kết sau: EN ≡ N = 945 kJ mol-1; EH – H = 436 kJ mol-1. Tính EN – H.
b) Tính enthalpy tạo thành chuẩn của NH3 (g).
Đáp án đề thi Giữa học kì 2 môn Hóa học lớp 10 Cánh diều - Đề số 2
Phần I: Trắc nghiệm
|
1 - A |
2 - D |
3 - C |
4 - B |
5 - A |
6 - B |
7 - D |
8 - B |
9 - D |
10 - D |
|
11 - A |
12 - A |
13 - B |
14 - C |
15 - D |
16 - B |
17 - D |
18 - A |
19 - C |
20 - B |
|
21 - B |
22 - A |
23 - A |
24 - B |
25 - B |
26 - A |
27 - D |
28 - C |
|
|
Câu 4:
Số oxi hóa của O là -2; đặt số oxi hóa của N là x, ta có:
x + 3. (-2) = -1 ⇒ x = +5.
Câu 11:
Ta có:
Phương trình hóa học:
Có 10 phân tử HNO3 tham gia phản ứng, trong đó có 1 phân tử HNO3 đóng vai trò chất oxi hóa (bị khử thành NO), 9 phân tử HNO3 đóng vai trò môi trường.
Câu 12:
Ta có:
Phương trình hóa học:
Tổng hệ số cân bằng (là số nguyên, tối giản) của chất tham gia phản ứng là: 2 + 3 = 5.
Câu 13:
a + b (đặc) c + d + fH2O
Quá trình nhường – nhận e:
Phương trình hóa học: 4Zn + 5H2SO4(đặc) 4ZnSO4 + H2S + 4H2O.
Giá trị của b trong phương trình hóa học trên là 5.
Câu 14:
Gọi nNO = a (mol), ta có các quá trình:

VNO = 0,15.24,79 = 3,7185 (L).
Câu 20:
1 mol khí ở điều kiện chuẩn tương đương 24,79 L
Phản ứng đốt cháy 1 mol hay 24,79L khí carbon monoxide (CO) tỏa ra nhiệt lượng là 283,0kJ.
⇒ Nếu đốt cháy hoàn toàn 2,479 L khí CO thì nhiệt lượng toả ra là:
.
Câu 22:
=
⇒ – 890,3 = [(– 393,5) + (– 285,8.2)] – [ + 0.2]
⇒ = – 74,8 kJ.
Câu 23:
= (N2O4) – 2. (NO2)
= 9,16 – 2.33,18 = -57,2 (kJ) < 0
Phản ứng tỏa nhiệt, N2O4 bền hơn NO2.
Câu 24:
= EC=C + 4.EC-H + EH-H – EC-C – 6EC-H
= EC=C + EH-H – EC-C – 2EC-H
= 612 + 436 – 346 – 2.418 = -134 (kJ)
Câu 26:
Áp dụng công thức:
= EC≡O + ECl – Cl – EC=O – 2EC – Cl
Eb(C ≡ O) = 1075 kJ/ mol.
Phần II: Tự luận
Câu 1:
a)
Chất khử: SO2; chất oxi hoá: KMnO4.
Ta có các quá trình:
Phương trình hoá học:
5SO2 + 2KMnO4 + 2H2O → 2H2SO4 + K2SO4 + 2MnSO4
b) Theo phương trình hóa học ta có:
= 24,79.0,005 = 0,12395 L = 123,95 (mL).
Câu 2:
- Xét phản ứng:
Biến thiên enthalpy chuẩn của phản ứng:
Do < 0 nên phản ứng (1) diễn ra thuận lợi hay ở điều kiện chuẩn H2O2(l) kém bền, dễ dàng phân huỷ thành H2O(l) và O2(g).
- Xét phản ứng:
Biến thiên enthalpy chuẩn của phản ứng:
Do > 0 nên phản ứng (2) diễn ra không thuận lợi hay ở điều kiện chuẩn H2O(l) bền, khó bị phân huỷ.
Câu 3:
a) Phân tử NH3 có 3 liên kết N–H 2 phân tử NH3 có 6 liên kết N–H.
Ta có: = EN≡N + 3.EH–H – 6.EN–H
b) Enthalpy tạo thành chuẩn của NH3:
= 2.= – 46,5 kJ mol-1.
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa học kì 2
Năm học 2022 - 2023
Môn: Hóa học 10
Thời gian làm bài: 45 phút
Đề thi Giữa Học kì 2 Hóa học lớp 10 Cánh diều có đáp án - (Đề số 3)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Số oxi hóa của iron, oxygen, hydrogen, sodium trong Fe, O2, H2, Na lần lượt là
A. +3, -2, +1, +1.
B. 0, 0, 0, 0.
C. +2, -2, +1, +1.
D. +3, -2, 0, 0.
Câu 2: Số oxi hoá của một nguyên tử một nguyên tố trong hợp chất là
A. hoá trị của nguyên tử nguyên tố đó.
B. giá trị điện tích của nguyên tử nguyên tố đó.
C. điện tích của nguyên tử nguyên tố đó với giả định đây là hợp chất cộng hoá trị.
D. điện tích của nguyên tử nguyên tố đó với giả định đây là hợp chất ion.
Câu 3: Số oxi hóa của manganese (Mn) trong KMnO4 là
A. +1.
B. +5.
C. +7.
D. -2.
Câu 4: Kim loại trong hợp chất nào sau đây có số oxi hoá là +2 ?
A. Al2O3.
B. Na2O.
C. MgO.
D. KCl.
Câu 5: Khi tham gia các phản ứng đốt cháy nhiên liệu, oxygen đóng vai trò là
A. chất khử.
B. chất oxi hóa.
C. acid.
D. base.
Câu 6: Trong phản ứng oxi hóa – khử:
A. chất bị oxi hóa nhận electron và chất bị khử cho electron.
B. quá trình oxi hóa và quá trình khử xảy ra đồng thời.
C. chất chứa nguyên tố số oxi hóa cực đại luôn là chất khử.
D. quá trình nhận electron gọi là quá trình oxi hóa.
Câu 7: Dẫn khí chlorine vào dung dịch KBr xảy ra phản ứng hoá học:
Cl2 + 2KBr → 2KCl + Br2
Trong phản ứng hoá học trên, xảy ra quá trình oxi hoá chất nào?
A. KCl.
B. Br2.
C. Cl2.
D. KBr.
Câu 8: Cho phản ứng: FeO + HNO3 ® Fe(NO3)3 + NO + H2O. Trong phản ứng này có bao nhiêu phân tử HNO3 đóng vai trò là chất oxi hóa?
A. 1.
B. 4.
C. 8.
D. 10.
Câu 9: Copper(II) oxide (CuO) bị khử bởi ammonia (NH3) theo phản ứng sau:
Tổng hệ số cân bằng (tối giản) của phản ứng là?
A. 11.
B. 12.
C. 13.
D. 14.
Câu 10: Sodium peroxide (Na2O2), potassium superoxide (KO2) được sử dụng trong bình lặn để hấp thụ khí carbon dioxide và cung cấp khí oxygen cho con người theo các phản ứng sau:
Na2O2 + CO2 Na2CO3 + O2↑
KO2 + CO2 K2CO3 + O2↑
Để thể tích khí carbon dioxide hấp thụ bằng thể tích khí oxygen sinh ra cần trộn Na2O2 và KO2 theo tỉ lệ số mol là
A. 1 : 2.
B. 1 : 3.
C. 1 : 4.
D. 3 : 1.
Câu 11: Cho 8,4 gam Fe phản ứng hoàn toàn với lượng dư dung dịch HNO3, thể tích khí NO (đkc) bay ra là (coi NO là sản phẩm khử duy nhất)
A. 2,2400 lít.
B. 3,3600 lít.
C. 3,7185 lít .
D. 5,6360 lít.
Câu 12: Phản ứng thu nhiệt là
A. phản ứng giải phóng năng lượng dưới dạng nhiệt.
B. phản ứng hấp thụ năng lượng dưới dạng nhiệt.
C. phản ứng có biến thiên enthalpy có giá trị âm.
D. phản ứng có biến thiên enthalpy bằng không.
Câu 13: Cho các phản ứng sau:
(a) Phản ứng phân huỷ NH4Cl(s) tạo ra HCl(g) và NH3(g).
(b) Phản ứng thuỷ phân collagen thành gelatin diễn ra khi hầm xương động vật.
(c) Phản ứng nung clinker xi măng.
(d) Phản ứng oxi hoá glucose trong cơ thể.
Số phản ứng toả nhiệt là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 14: Để thuận tiện cho việc so sánh lượng nhiệt kèm theo, người ta sử dụng điều kiện chuẩn và quy định là
A. Điều kiện chuẩn là điều kiện ứng với áp suất 1 bar (đối với chất khí), nồng độ 1 mol L (đối với chất tan trong dung dịch) và nhiệt độ thường chọn là 25K.
B. Điều kiện chuẩn là điều kiện ứng với áp suất 1 atm (đối với chất khí), nồng độ 1 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường chọn là 298K.
C. Điều kiện chuẩn là điều kiện ứng với áp suất 1 mmHg (đối với chất khí), nồng độ 1 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường chọn là 25K.
D. Điều kiện chuẩn là điều kiện ứng với áp suất 1 bar (đối với chất khí), nồng độ 1 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường chọn là 298K.
Câu 15: Biến thiên enthalpy chuẩn của một phản ứng hoá học, kí hiệu là
A.
B.
C.
D.
Câu 16: Enthalpy tạo thành chuẩn (hay nhiệt tạo thành chuẩn) của một chất là
A. nhiệt kèm theo của một phản ứng hoá học ở áp suất không đổi.
B. lượng nhiệt toả ra của phản ứng ở điều kiện chuẩn.
C. lượng nhiệt kèm theo của phản ứng tạo thành 1 mol chất đó từ các đơn chất.
D. lượng nhiệt kèm theo của phản ứng tạo thành 1 mol chất đó từ các đơn chất ở dạng bền nhất trong điều kiện chuẩn.
Câu 17: Cho phản ứng sau:
H2(g) + I2(s) → 2HI(g)
Enthalpy tạo thành chuẩn của hydrogen iodide (HI) ở thể khí là
A. +53 kJ/ mol.
B. -53 kJ/ mol.
C. -26,5 kJ/ mol.
D. +26,5 kJ/ mol.
Câu 18: Cho hai phản ứng cùng xảy ra ở điều kiện chuẩn:
(1) N2(g) + O2(g) → 2NO(g)
(2)
Phát biểu nào sau đây không đúng?
A. Enthalpy tạo thành chuẩn của NO(g) là .
B. Biến thiên enthalpy chuẩn của phản ứng giữa 1 mol N2(g) với 1 mol O2(g) tạo thành 2 mol NO (g) là .
C. Biến thiên enthalpy chuẩn của phản ứng giữa 1 mol khí NO(g) với 0,5 mol khí O2(g) tạo thành 1 mol khí NO2(g) là .
D. Enthalpy tạo thành chuẩn của NO2 (g) là: .
Câu 19: Đốt cháy hoàn toàn 1 gam C2H2(g) ở điều kiện chuẩn, thu được CO2(g) và H2O(l), giải phóng 50,01 kJ. Biến thiên enthalpy chuẩn của phản ứng đốt cháy 1 mol C2H2 là
A. – 1300,26 kJ.
B. 1300,26 kJ.
C. 650,13 kJ.
D. – 650,13 kJ.
Câu 20: Cho các phản ứng sau:
(a) C(s) + O2(g) → CO2(g)
(b)
(c) CH4(g) + H2O(l) → CO(g) + 3H2(g)
(d) H2(g) + Cl2(g) → 2HCl(g)
Số phản ứng thu nhiệt là
A. 4.
B. 3.
C. 2.
D. 1.
Câu 21: Phản ứng hoá học nào sau đây không cần phải khơi mào?
A. Phản ứng nung vôi.
B. Phản ứng đốt than.
C. Phản ứng tạo gỉ sắt.
D. Phản ứng phân huỷ thuốc tím.
Câu 22: Cho giản đồ sau:
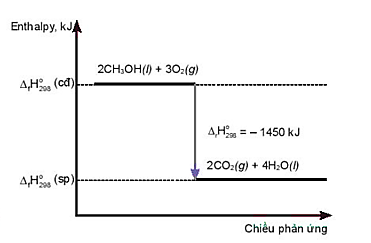
Nhận xét nào sau đây là sai?
A. Phản ứng toả nhiệt.
B. Phản ứng thu nhiệt.
C. Nhiệt lượng toả ra của phản ứng là 1450 kJ.
D. Phương trình hoá học của phản ứng là: 2CH3OH(l) + 3O2(g) → 2CO2(g) + 4H2O(l).
Câu 23: Cho phản ứng sau: 2SO2(g) + O2(g) → 2SO3(l). Biến thiên enthalpy chuẩn của phản ứng này được tính theo công thức là
A.
B.
C.
D.
Câu 24: Cho phản ứng nhiệt nhôm sau:
2Al(s) + Fe2O3(s) 2Fe(s) + Al2O3(s)
Biến thiên enthalpy chuẩn của phản ứng nhiệt nhôm là
Biết:
|
Chất |
Al (s) |
Fe2O3 (s) |
Fe (s) |
Al2O3 (s) |
|
(kJmol-1) |
0 |
-825,5 |
0 |
-1676,0 |
A. +850,5 kJ.
B. - 850,5 kJ.
C. -839 kJ.
D. +839 kJ.
Câu 25: Muối ammonium bicarbonate (NH4HCO3) được sử dụng làm bột nở, giúp cho bánh nở to, xốp và mềm. Dựa vào phản ứng và các dữ kiện sau hãy lựa chọn cách bảo quản ammonium bicarbonate đúng?
NH4HCO3 (s) NH3 (g) + CO2 (g) + H2O (g)
|
Chất |
NH4HCO3 (s) |
NH3 (g) |
CO2 (g) |
H2O (g) |
|
(kJmol-1) |
–849,40 |
–46,11 |
–393,51 |
–241,82 |
A. Bảo quản nơi thoáng mát, tránh ánh sáng Mặt Trời và tránh nhiệt độ cao.
B. Bảo quản nơi kín gió, có ánh sáng Mặt Trời.
C. Bảo quản nơi thoáng mát, khô ráo, có nhiệt độ cao, nhiều ánh nắng Mặt Trời.
D. Bảo quản nơi thoáng mát, khô ráo, nhiều ánh sáng Mặt Trời.
Câu 26: Cho phản ứng tổng quát: aA + bB → mM + nN. Hãy chọn phương án tính đúng của phản ứng:
A. .
B. .
C. .
D. .
Câu 27: Cho phản ứng hóa học sau:
H2C=CH2(g) + H2(g) → H3C-CH3(g)
Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:
|
Liên kết |
C – H |
C – C |
C = C |
H - H |
|
Eb (kJ/mol) |
418 |
346 |
612 |
436 |
Biến thiên enthalpy chuẩn của phản ứng là
A. +134 kJ.
B. -134 kJ.
C. +478 kJ.
D. +284 kJ.
Câu 28: Cho phương trình nhiệt hóa học của phản ứng:
Nhận xét nào sau đây là đúng?
A. Phản ứng tỏa nhiệt mạnh.
B. Phản ứng xảy ra thuận lợi ở điều kiện thường.
C. Phản ứng xảy ra dưới điều kiện nhiệt độ thấp.
D. Phản ứng thu nhiệt.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Thực hiện thí nghiệm xác định công thức của một oxide của kim loại sắt bằng nitric acid đặc, nóng thu được 2,479 lít (đkc) khí màu nâu là nitrogen dioxide. Phần dung dịch đem cô cạn thu được 72,6 gam Fe(NO3)3. Giả sử phản ứng không tạo thành các sản phẩm khác (biết 1 mol khí chiếm 24,79 lít đo ở đkc 25oC, 1bar). Xác định công thức của oxide.
Câu 2 (1 điểm): Cho phản ứng:
Xác định giá trị của khi:
a. Lấy gấp 3 lần khối lượng của các chất phản ứng.
b. Lấy một nửa khối lượng của các chất phản ứng
c. Đảo chiều của phản ứng.
Câu 3 (1 điểm): Xác định năng lượng liên kết H–Cl của khí HCl từ các giá trị sau:
EH–H = 436 kJ mol-1;
ECl–Cl = 242 kJ mol-1;
HCl (g) = –92,31 kJ mol-1.
Phòng Giáo dục và Đào tạo .....
Đề khảo sát chất lượng Giữa học kì 2
Năm học 2022 - 2023
Môn: Hóa học 10
Thời gian làm bài: 45 phút
Đề thi Giữa Học kì 2 Hóa học lớp 10 Cánh diều có đáp án - (Đề số 4)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Số oxi hóa của bromine trong KBr là
A. 0.
B. +1.
C. -1.
D. +2.
Câu 2: Dấu hiệu để nhận biết một phản ứng oxi hóa – khử là dựa trên sự thay đổi đại lượng nào sau đây của nguyên tử?
A. Số khối.
B. Số oxi hóa.
C. Số hiệu nguyên tử.
D. Số mol.
Câu 3: Số oxi hóa của nitrogen trong NO3- là
A. +6.
B. +5.
C. +4.
D. +3.
Câu 4: Phát biểu nào sau đây là sai?
A. Trong hợp chất NaH, số oxi hoá của hydrogen là +1.
B. Số oxi hoá của nguyên tử nguyên tố trong đơn chất bằng 0.
C. Số oxi hoá của kim loại nhóm IA trong hợp chất là +1.
D. Thông thường, số oxi hoá của oxygen trong hợp chất là -2.
Câu 5: Dựa theo số oxi hoá, các phản ứng hoá học được phân thành
A. phản ứng vô cơ và phản ứng hữu cơ.
B. phản ứng có sự thay đổi số oxi hoá và phản ứng không có sự thay đổi số oxi hoá.
C. phản ứng hoá hợp và phản ứng phân huỷ.
D. phản ứng oxi hoá – khử và phản ứng trao đổi.
Câu 6: Chất bị oxi hoá là
A. chất nhận electron.
B. chất nhường electron.
C. chất có số oxi hoá giảm xuống sau phản ứng.
D. chất có số oxi hoá không thay đổi sau phản ứng.
Câu 7: Phản ứng nào sau đây là phản ứng oxi hoá – khử?
A. KCl + AgNO3 → AgCl + KNO3.
B. 3Fe2O3 + CO 2Fe3O4 + CO2.
C. MgO + 2HCl → MgCl2 + H2O.
D. Na2CO3 + H2SO4 → Na2SO4 + CO2 + H2O.
Câu 8: Cho phản ứng oxi hoá – khử sau: 4NH3 + 5O2 → 4NO + 6H2O. Chất khử trong phản ứng là
A. NH3.
B. O2.
C. NO.
D. H2O.
Câu 9: Cho phản ứng nhiệt nhôm: 2Al + Fe2O3 Al2O3 + 3Fe. Phát biểu nào sau đây sai?
A. Al là chất khử.
B. Fe2O3 là chất oxi hóa.
C. Tỉ lệ giữa chất bị khử : chất bị oxi hóa là 2 : 1.
D. Sản phẩm khử là Fe.
Câu 10: Cho phương trình hóa học: aFe + bH2SO4 → cFe2(SO4)3 + dSO2 + eH2O (với a, b, c, d, e là các hệ số cân bằng của phản ứng). Tỉ lệ a : b là
A. 1 : 1.
B. 2 : 3.
C. 1 : 3.
D. 1 : 2.
Câu 11: Hàm lượng iron (II) sulfate được xác định qua phản ứng oxi hóa – khử với potassium permanganate theo sơ đồ sau:
FeSO4 + KMnO4 + H2SO4 - - - → Fe2(SO4)3 + K2SO4 + MnSO4 + H2O
Thể tích KMnO4 0,02M để phản ứng vừa đủ 20 mL dung dịch FeSO4 0,1M là
A. 20 mL.
B. 30 mL.
C. 40 mL.
D. 50 mL.
Câu 12: Cho các phản ứng sau:
(1) Phản ứng nung vôi: CaCO3(s) → CaO(s) + CO2(g).
(2) Phản ứng đốt cháy khí methane: CH4(g) + 2O2(g) → CO2(g) + 2H2O(l).
Nhận xét nào sau đây là đúng?
A. Cả hai phản ứng đều thu nhiệt.
B. Cả hai phản ứng đều toả nhiệt.
C. Phản ứng (1) toả nhiệt, phản ứng (2) thu nhiệt.
D. Phản ứng (1) thu nhiệt, phản ứng (2) toả nhiệt.
Câu 13: Nhận xét nào sau đây về phản ứng toả nhiệt là sai?
A. Phản ứng giải phóng năng lượng dưới dạng nhiệt là phản ứng toả nhiệt.
B. Phản ứng toả nhiệt thì biến thiên enthalpy của phản ứng có giá trị âm.
C. Biến thiên enthalpy càng âm, phản ứng toả ra càng nhiều nhiệt.
D. Biến thiên enthalpy càng dương, phản ứng toả ra càng nhiều nhiệt.
Câu 14: Cho các phản ứng sau:
(a) Phản ứng tạo gỉ kim loại.
(b) Phản ứng quang hợp của cây xanh.
(c) Phản ứng nhiệt phân thuốc tím.
(d) Phản ứng đốt cháy cồn (alcohol).
Số phản ứng thu nhiệt là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 15: Enthalpy tạo thành chuẩn (hay nhiệt tạo thành chuẩn) của một chất, kí hiệu là
A.
B.
C.
D.
Câu 16: Cho phản ứng sau:
4Na(s) + O2(g) → 2Na2O(s)
Enthalpy tạo thành của Na2O rắn ở điều kiện chuẩn là
A. – 836 kJ/ mol.
B. + 836 kJ/ mol.
C. – 418 kJ/ mol.
D. + 418 kJ/ mol.
Câu 17: Nhiệt kèm theo (nhiệt lượng toả ra hay thu vào) của một phản ứng hoá học ở áp suất không đổi (và thường ở một nhiệt độ xác định) gọi là
A. enthalpy tạo thành chuẩn của một chất.
B. enthalpy tạo thành của một chất.
C. biến thiên enthalpy chuẩn của phản ứng hoá học.
D. biến thiên enthalpy của phản ứng.
Câu 18: Cho phản ứng:
H2(g) + Cl2(g) → 2HCl(g)
Trong các phát biểu sau:
(a) Biến thiên enthalpy chuẩn của phản ứng trên là – 184,6 kJ.
(b) Biến thiên enthalpy chuẩn của phản ứng trên là – 92,3 kJ.
(c) Nhiệt tạo thành chuẩn của HCl(g) là – 92,3 kJ.
(d) Nhiệt tạo thành chuẩn của HCl(g) là 92,3 kJ.
Số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 19: Trong phản ứng thu nhiệt, dấu của ∆H dương vì
A. năng lượng của hệ chất phản ứng cao hơn năng lượng của hệ sản phẩm.
B. năng lượng của hệ chất phản ứng thấp hơn năng lượng của hệ sản phẩm.
C. phản ứng diễn ra kèm theo sự giải phóng năng lượng dưới dạng nhiệt.
D. năng lượng của hệ sản phẩm thấp hơn năng lượng của hệ chất phản ứng.
Câu 20: Cho giản đồ năng lượng sau:
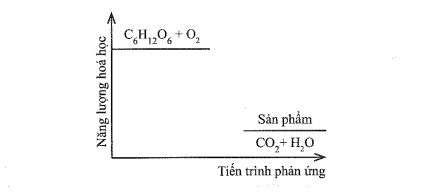 Nhận xét nào sau đây là đúng?
Nhận xét nào sau đây là đúng?
A. Phản ứng thu nhiệt.
B. Phản ứng toả nhiệt.
C. Năng lượng hệ chất phản ứng thấp hơn năng lượng sản phẩm.
D. Phản ứng xảy ra kèm theo sự hấp thụ năng lượng dưới dạng nhiệt.
Câu 21: Cho các phản ứng sau:
(a) C(s) + O2(g) → CO2(g)
(b)
(c) CH4(g) + H2O(l) → CO(g) + 3H2(g)
(d) H2(g) + I2(s) → 2HI(g)
Phản ứng toả nhiệt là
A. (a) và (b).
B. (c) và (d).
C. (b) và (d).
D. (a) và (c).
Câu 22: Phát biểu nào sau đây là sai ?
A. Hầu hết các phản ứng thu nhiệt cần khơi mào (đun hoặc đốt nóng …).
B. Tất cả các phản ứng toả nhiệt đều không cần khơi mào.
C. Một số phản ứng thu nhiệt diễn ra bằng cách lấy nhiệt từ môi trường bên ngoài nên làm cho nhiệt độ môi trường xung quanh giảm đi.
D. Phản ứng trung hoà acid – base không cần khơi mào.
Câu 23: Cho phản ứng hoá học sau: 2NaCl(s) → 2Na(s) + Cl2(g). Biến thiên enthalpy chuẩn của phản ứng này được tính theo công thức là
A.
B.
C.
D.
Câu 24: Cho phản ứng đốt cháy ethane:
C2H6 (g) + O2 (g) 2CO2 (g) + 3H2O (l)
Biến thiên enthalpy chuẩn của phản ứng đốt cháy ethane là
Biết:
|
Chất |
C2H6 (g) |
O2 (g) |
CO2 (g) |
H2O (l) |
|
(kJmol-1) |
-87,1 |
0 |
-393,5 |
-285,8 |
A. - 1559,7 (kJ).
B. +1559,7 (kJ).
C. - 1644,4 (kJ).
D. +1644,4 (kJ).
Câu 25: Cho phản ứng sau:
Biết nhiệt tạo thành chuẩn của CO2:
Nhiệt tạo thành chuẩn của CO là
A. –110,5 kJ/mol.
B. +110,5 kJ/mol.
C. –141,5 kJ/mol.
D. –221,0 kJ/mol.
Câu 26: Cho phản ứng hóa học sau: CH4(g) + Cl2(g) → CH3Cl(g) + HCl(g). Biến thiên enthalpy chuẩn của phản ứng này được tính theo công thức là
A. .
B. .
C.
D.
Câu 27: Cho phản ứng hóa học sau:
2H2(g) + O2(g) 2H2O(g)
Biến thiên enthalpy chuẩn của phản ứng là
Biết: Eb(H-H) = 432 kJ/mol; Eb(O=O) = 498 kJ/mol; Eb(O-H) = 467 kJ/mol.
A. -560 kJ.
B. -506 kJ.
C. +560 kJ.
D. +506 kJ.
Câu 28: Cho phản ứng đốt cháy octane như sau:
C8H18 (g) + → 8CO2 (g) + 9H2O (l)
Cho giá trị trung bình của các năng lượng liên kết ở điều kiện chuẩn:
|
Liên kết |
C – H |
C – C |
O = O |
C = O |
H - O |
|
Eb (kJ/mol) |
414 |
347 |
498 |
799 |
x |
Giá trị của x là
A. 305.
B. 360.
C. 464.
D. 837.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Để xác định hàm lượng ethanol trong máu của người lái xe cần chuẩn độ ethanol bằng K2Cr2O7 trong môi trường acid. Khi đó bị khử thành , ethanol (C2H5OH) bị oxi hóa thành acetaldehyde (CH3CHO).
(a) Hãy viết phương trình hóa học của phản ứng.
(b) Khi chuẩn độ 25 gam huyết tương máu của một lái xe cần dùng 20 ml dung dịch K2Cr2O7 0,01M. Xác định nồng độ C2H5OH có trong máu của người lái xe này.
Giả sử rằng trong thí nghiệm trên chỉ có ethanol tác dụng với K2Cr2O7.
Câu 2 (1 điểm): Rượu vang là loại thức uống có cồn lên men từ nho với lịch sử phong phú hàng ngàn năm. Men tiêu thụ đường (glucose) trong nho, chuyển hóa thành rượu (ethanol) và giải phóng khí carbon dioxide:
C6H12O6 (s) 2C2H5OH (l) + 2CO2 (g)
Biết (kJ mol-1) của C6H12O6; C2H5OH và CO2 lần lượt là: –1274; –277,69; –393,51.
a. Quá trình lên men rượu vang cần cung cấp nhiệt hay không? Giải thích.
b. Tính lượng nhiệt tỏa ra hay thu vào khi lên men 1 kg nho (chứa khoảng 7% đường glucose) ở điều kiện chuẩn.
Câu 3 (1 điểm): Cho phản ứng sau:
2HBr (g) + Cl2 (g) 2HCl (g) + Br2 (g) = –80,91 kJ
Tính giá trị EBr–Br dựa vào bảng số liệu sau:
|
|
H–Br |
Cl–Cl |
H–Cl |
|
Eb (kJ mol-1) |
366 |
242 |
431 |
|
(kJ mol-1) |
–36,40 |
0 |
–92,31 |
Xem thêm đề thi các môn lớp 10 bộ Cánh diều hay, có đáp án chi tiết:
Bộ 30 đề thi Giữa học kì 2 Toán lớp 10 Cánh diều có đáp án
Bộ 30 đề thi Giữa học kì 2 Ngữ văn lớp 10 Cánh diều có đáp án
Bộ 30 đề thi Giữa học kì 2 Tiếng anh lớp 10 Explore new worlds có đáp án | Cánh diều
Bộ 30 đề thi Giữa học kì 2 Vật lý lớp 10 Cánh diều có đáp án
Bộ 30 đề thi Giữa học kì 2 Sinh học lớp 10 Cánh diều có đáp án
Bộ 30 đề thi Giữa học kì 2 Lịch sử lớp 10 Cánh diều có đáp án
Bộ 30 đề thi Giữa học kì 2 Địa lí lớp 10 Cánh diều có đáp án
Bộ 30 đề thi Giữa học kì 2 Tin học lớp 10 Cánh diều có đáp án
Bộ 30 đề thi Giữa học kì 2 Công nghệ lớp 10 Cánh diều có đáp án (Trồng trọt)
Bộ 30 đề thi Giữa học kì 2 Công nghệ lớp 10 Cánh diều có đáp án (Thiết kế)


