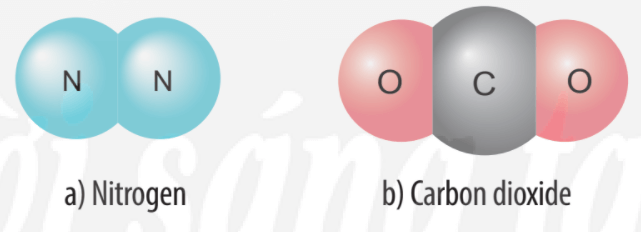Giải Khoa học tự nhiên 7 (Chân trời sáng tạo) Bài 6: Giới thiệu về liên kết hóa học
Hoidapvietjack.com trân trọng giới thiệu: lời giải bài tập Khoa học tự nhiên lớp 7 Bài 6: Giới thiệu về liên kết hóa học Chân trời sáng tạo hay nhất, chi tiết sẽ giúp học sinh dễ dàng trả lời câu hỏi và làm bài tập KHTN 7 Bài 6.
Giải bài tập Khoa học tự nhiên 7 Bài 6: Giới thiệu về liên kết hóa học
Video giải bài tập Khoa học tự nhiên 7 Bài 6: Giới thiệu về liên kết hóa học
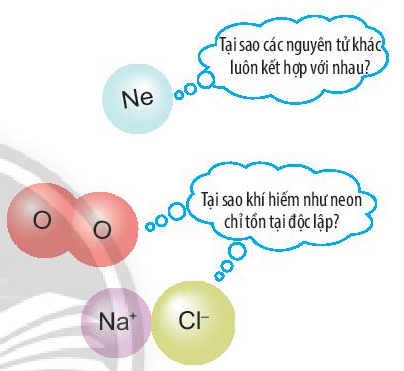
Mở đầu trang 37 Bài 6 KHTN lớp 7: Ở điều kiện thường, các nguyên tử khí hiếm thường trơ, bền và chỉ tồn tại độc lập, trong khi các nguyên tử của nguyên tố khác lại có xu hướng kết hợp với nhau.
Các nguyên tử của nguyên tố kết hợp với nhau theo quy tắc nào?
Trả lời:
Các nguyên tử của nguyên tố có xu hướng kết hợp với nhau để có số electron ở lớp ngoài cùng giống nguyên tử của nguyên tố khí hiếm.
1. Vỏ nguyên tử khí hiếm
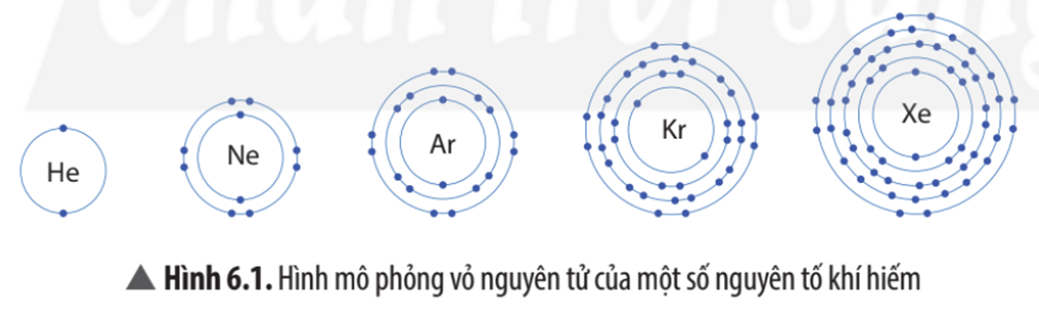
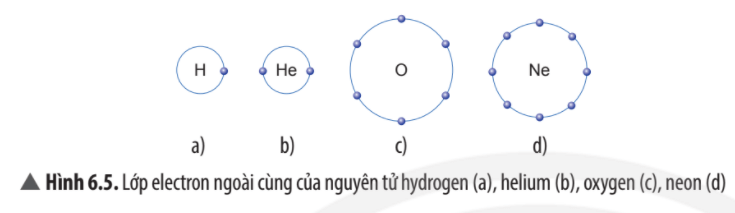
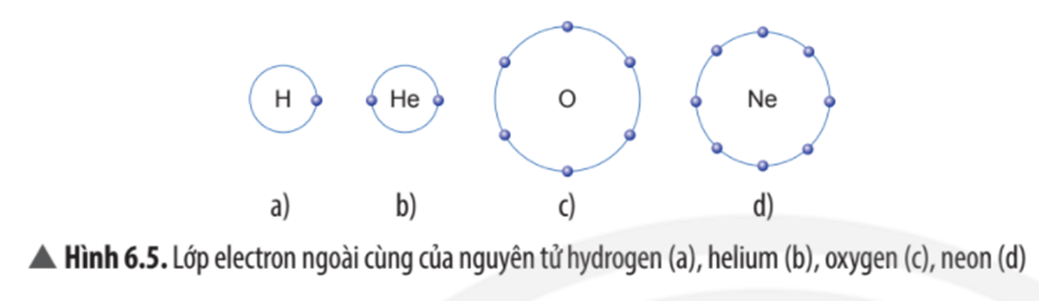
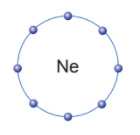
Câu hỏi thảo luận 1 trang 37 Khoa học tự nhiên 7: Trừ helium, vỏ nguyên tử của các nguyên tố còn lại ở Hình 6.1 có những điểm giống và khác nhau gì?
Trả lời:
Vỏ nguyên tử của các nguyên tố khí hiếm đều có 8 electron ở lớp ngoài cùng, riêng helium ở lớp ngoài cùng chỉ có 2 electron.
2. Liên kết ion
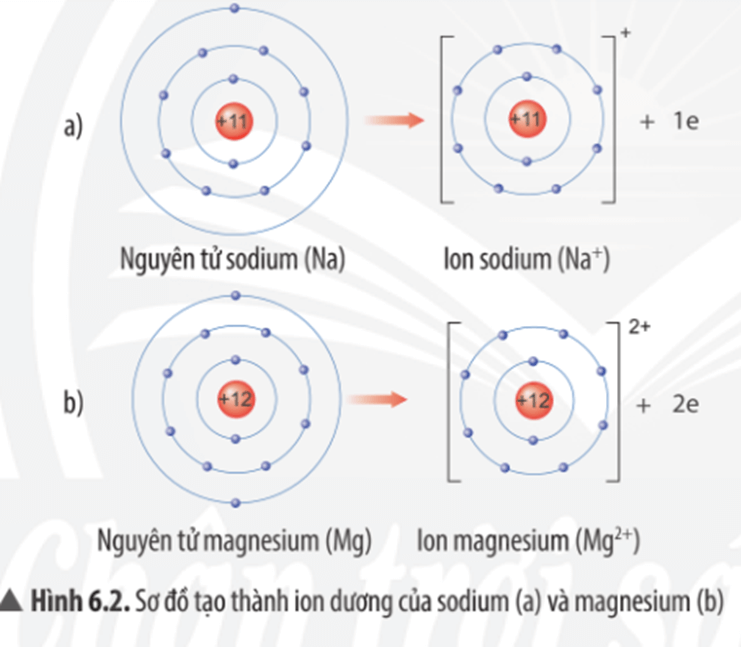
Câu hỏi thảo luận 2 trang 38 KHTN lớp 7: Quan sát Hình 6.2, em hãy mô tả sự tạo thành ion sodium, ion magnesium. Nhận xét về số electron lớp ngoài cùng của các ion này và cho biết sự phân bố electron của 2 ion này giống sự phân bố electron của nguyên tử khí hiếm nào?
Trả lời:
Mô tả sự tạo thành ion sodium, ion magnesium:
- Nguyên tử sodium (Na) nhường đi 1 electron ở lớp vỏ ngoài cùng để trở thành ion sodium mang điện tích dương, kí hiệu Na+.
- Nguyên tử magnesium (Mg) nhường đi 2 electron ở lớp vỏ ngoài cùng để trở thành ion magnesium mang điện tích dương, kí hiệu Mg2+.
Nhận xét:
- Các ion này đều có 8 electron lớp ngoài cùng.
- Sự phân bố electron của ion sodium (Na+) và ion magnesium (Mg2+) đều giống với sự phân bố electron của nguyên tử khí hiếm neon (Ne).
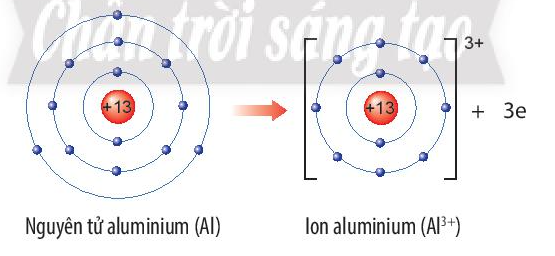
 Luyện tập trang 38 KHTN lớp 7: Hãy xác định vị trí của aluminium trong bảng tuần hoàn và vẽ sơ đồ tạo thành ion aluminium từ nguyên tử aluminium.
Luyện tập trang 38 KHTN lớp 7: Hãy xác định vị trí của aluminium trong bảng tuần hoàn và vẽ sơ đồ tạo thành ion aluminium từ nguyên tử aluminium.
Trả lời:
Aluminium (Al) thuộc ô số 13, chu kì 3, nhóm IIIA trong bảng tuần hoàn.
Nguyên tử aluminium nhường 3 electron ở lớp ngoài cùng để trở thành ion aluminium, kí hiệu Al3+
Sơ đồ tạo thành ion aluminium:
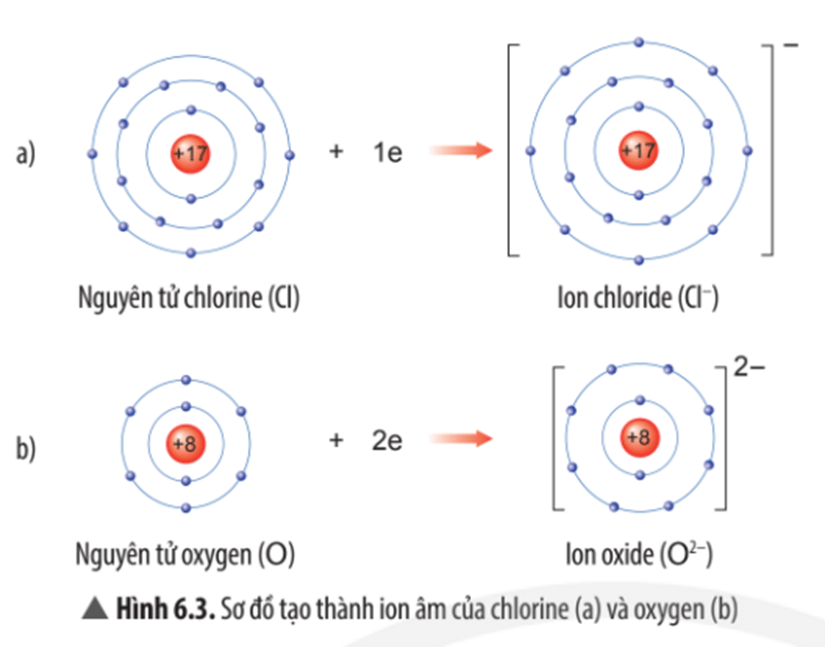
 Câu hỏi thảo luận 3 trang 38 KHTN lớp 7: Quan sát Hình 6.3, em hãy mô tả sự tạo thành ion chloride, ion oxide. Nhận xét về số electron lớp ngoài cùng của các ion này và cho biết sự phân bố electron của 2 ion này giống sự phân bố electron của nguyên tử khí hiếm nào?
Câu hỏi thảo luận 3 trang 38 KHTN lớp 7: Quan sát Hình 6.3, em hãy mô tả sự tạo thành ion chloride, ion oxide. Nhận xét về số electron lớp ngoài cùng của các ion này và cho biết sự phân bố electron của 2 ion này giống sự phân bố electron của nguyên tử khí hiếm nào?
Trả lời:
Mô tả sự tạo thành ion chloride, ion oxide:
- Nguyên tử chlorine nhận thêm 1 electron vào lớp electron ngoài cùng để trở thành ion chloride mang điện tích âm, kí hiệu Cl-;
- Nguyên tử oxygen nhận thêm 2 electron vào lớp electron ngoài cùng để trở thành ion oxide mang điện tích âm, kí hiệu O2-.
Nhận xét:
- Lớp vỏ của các ion chloride và ion oxide đều có 8 electron lớp ngoài cùng.
- Sự phân bố electron của ion chloride giống với sự phân bố electron của nguyên tử khí hiếm argon (Ar).
 - Sự phân bố electron của ion oxide giống với sự phân bố electron của nguyên tử khí hiếm neon (Ne).
- Sự phân bố electron của ion oxide giống với sự phân bố electron của nguyên tử khí hiếm neon (Ne).

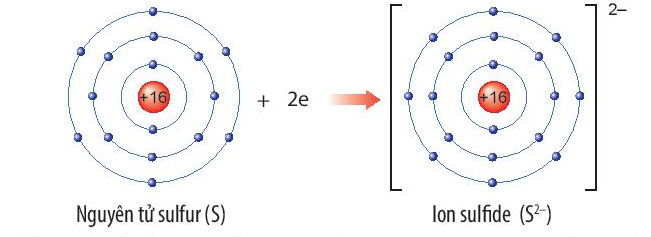
Luyện tập trang 39 KHTN lớp 7: Xác định vị trí của sulfur trong bảng tuần hoàn và vẽ sơ đồ tạo thành ion sulfide (S2-) từ nguyên tử sulfur.
Trả lời:
Nguyên tố sulfur (S) thuộc ô thứ 16, chu kì 3, nhóm VIA trong bảng tuần hoàn.
Nguyên tử sulfur nhận thêm 2 electron để trở thành ion ion sulfide (S2-). Ion sulfide (S2-) có 8 electron lớp ngoài cùng, sự phân bố electron trên ion sulfide (S2-) giống với sự phân bố electron của nguyên tử khí hiếm argon (Ar).
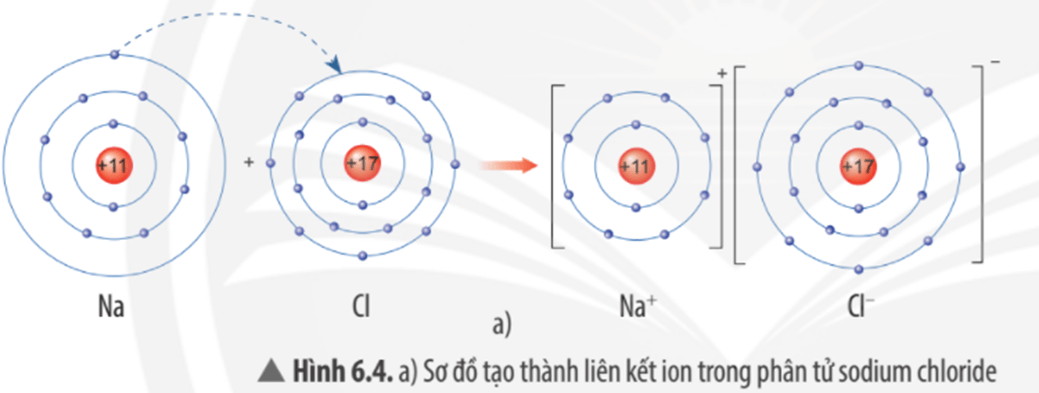
Câu hỏi thảo luận 4 trang 39 KHTN lớp 7: Quan sát Hình 6.4a, em hãy mô tả quá trình tạo thành liên kết ion trong phân tử sodium chloride. Nêu một số ứng dụng của sodium chloride trong đời sống.
Trả lời:
Mô tả quá trình tạo thành liên kết ion trong phân tử sodium chloride:
Khi nguyên tử sodium (Na) kết hợp với nguyên tử chlorine (Cl), nguyên tử Na nhường 1 electron tạo thành ion dương, kí hiệu là Na+, đồng thời nguyên tử Cl nhận 1 electron từ nguyên tử Na tạo thành ion âm, kí hiệu Cl-. Ion Na+ và Cl- hút nhau tạo phân tử sodium chloride (NaCl).
Một số ứng dụng của sodium chloride trong đời sống:
- Trong công nghiệp:
+ Sodium chloride dùng sản xuất giấy, thuốc nhuộm;…
+ Sử dụng trong công nghiệp dệt may và sản xuất vải, sản xuất xà phòng, chất tẩy rửa.
+ Nguyên liệu ban đầu để sản xuất chlorine và xút.
+ Trong công nghiệp sản xuất giày da, người ta sử dụng sodium chloride để bảo vệ da.
+ Trong sản xuất cao su, sodium chloride được dùng để làm trắng các loại cao su.
+ Trong dầu khí, sodium chloride là thành phần quan trọng trong dung dịch khoan giếng.
+ Từ sodium chloride có thể chế ra các loại hóa chất dùng trong các ngành khác như sản xuất nhôm, đồng, thép, điều chế nước Javen, … bằng cách điện phân nóng chảy hoặc điện phân dung dịch sodium chloride có màng ngăn.
- Trong nông nghiệp và trong đời sống:
+ Giúp cân bằng sinh lí trong cơ thể con người, gia súc, gia cầm, …
+ Cung cấp thêm vi lượng khi trộn với các loại phân hữu cơ để tăng hiệu quả của phân bón;
+ Sodium chloride có tính hút ẩm, do đó được sử dụng để bảo quản thực phẩm, nó làm tăng áp suất thẩm thấu khiến vi khuẩn mất nước và chết.
+ Sodium chloride dùng để ướp thực phẩm tươi sống như tôm, cá, … để không bị ươn, ôi trước khi thực phẩm được nấu, vận chuyển đi xa, …
- Trong y tế:
+ Sát trùng vết thương;
+ Pha huyết thanh, thuốc tiêu độc và một số loại thuốc khác để chữa bệnh,
+ Cung cấp muối khoáng cho cơ thể;
+ Khử độc, thanh lọc cơ thể, làm đẹp da, chữa viêm họng, hôi miệng …
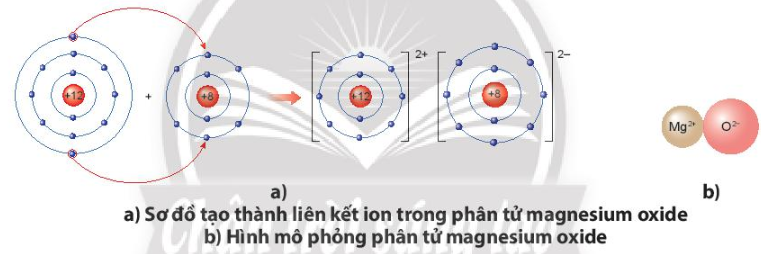
Luyện tập trang 39 KHTN lớp 7: Hãy vẽ sơ đồ và mô tả quá trình tạo thành liên kết ion trong phân tử hợp chất magnesium oxide.
Trả lời:
Khi nguyên tử magnesium (Mg) kết hợp với nguyên tử oxygen (O), nguyên tử magnesium nhường 2 electron tạo thành ion magnesium, mang điện tích dương, kí hiệu là Mg2+, đồng thời nguyên tử oxygen (O) nhận 2 electron từ nguyên tử Mg tạo thành ion oxide, mang điện tích âm, kí hiệu O2-. Ion Mg2+ và O2- hút nhau tạo phân tử magnesium oxide (MgO).
Vận dụng trang 39 KHTN lớp 7: Calcium chloride có nhiều ứng dụng trong đời sống. Tìm hiểu qua sách báo và internet, em hãy cho biết một số ứng dụng của chất này. Vẽ sơ đồ tạo thành liên kết trong phân tử calcium chloride.

Trả lời:
Sơ đồ tạo thành liên kết trong phân tử calcium chloride:
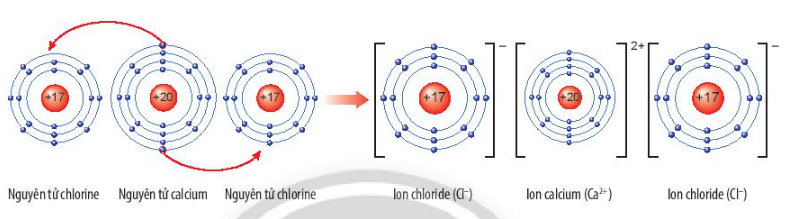
Ứng dụng của CaCl2:
- Dùng để làm khô trong quy trình chế biến thực phẩm đóng hộp và các loại tinh bột;
- Làm chất chống đóng băng trên mặt đường ở những quốc gia ôn đới hoặc làm chất chống diệt bụi, nấm mốc.
- Trong xây dựng, calcium chloride là chất làm tăng thời gian đông của bê tông.
- Trong công nghiệp luyện kim và sản xuất giấy, chất này đóng vai trò là chất phụ gia trong quá trình tải nhiệt và làm khô.
- Calcium chloride được ứng dụng trong hệ thống tiêu nước và xử lý nước thải công nghiệp;
- Là chất hỗ trợ giúp hút oxygen trong không khí, được ứng dụng làm thiết bị cứu hỏa.
3. Liên kết cộng hóa trị
Câu hỏi thảo luận 5 trang 40 KHTN lớp 7: Dựa vào bảng tuần hoàn, hãy chỉ ra nguyên tố khí hiếm gần nhất của hydrogen và oxygen. Để có lớp electron ngoài cùng giống nguyên tố khí hiếm gần nhất, nguyên tử hydrogen và oxygen có xu hướng gì?
Trả lời:
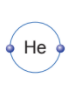
Nguyên tố khí hiếm gần nhất của hydrogen là helium (He).
Nguyên tử hydrogen có 1 electron lớp ngoài cùng, để có lớp electron ngoài cùng giống nguyên tố helium (2 electron lớp ngoài cùng) nguyên tử hydrogen có xu hướng thêm 1 electron.
Nguyên tố khí hiếm gần nhất của oxygen là neon (Ne).
Nguyên tử oxygen có 6 electron lớp ngoài cùng, để có lớp electron ngoài cùng giống nguyên tố neon (8 electron lớp ngoài cùng) nguyên tử oxygen có xu hướng thêm 2 electron.
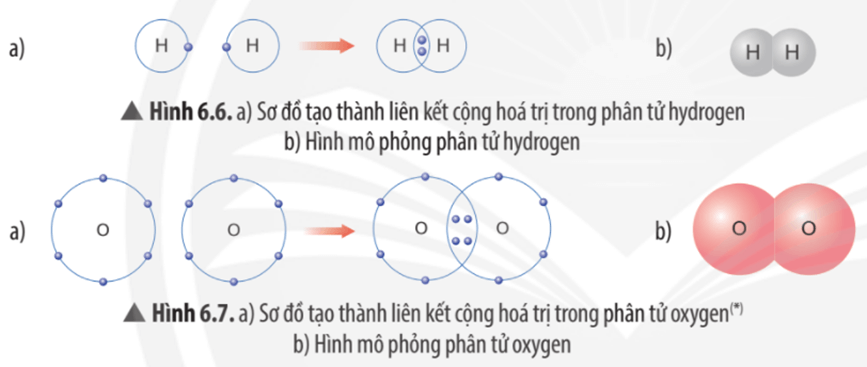
Câu hỏi thảo luận 6 trang 40 KHTN lớp 7: Dựa vào các Hình 6.5, 6.6 và 6.7, em hãy cho biết số electron lớp ngoài cùng của mỗi nguyên tử trong phân tử hydrogen và oxygen là bao nhiêu?
Khi đó, lớp electron ngoài cùng của nguyên tử hydrogen và nguyên tử oxygen sẽ giống với khí hiếm nào?
Trả lời:
- Trong phân tử hydrogen (H2), mỗi nguyên tử hydrogen (H) đều có 2 electron ở lớp ngoài cùng. Khi đó, lớp electron ngoài cùng của nguyên tử hydrogen giống với khí hiếm helium (He)
- Trong phân tử oxygen (O2), mỗi nguyên tử oxygen (O) đều có 8 electron ở lớp ngoài cùng. Khi đó, lớp electron ngoài cùng của nguyên tử oxygen giống với khí hiếm neon (Ne).
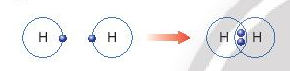
Câu hỏi thảo luận 7 trang 40 KHTN lớp 7: Em hãy mô tả quá trình tạo thành liên kết cộng hóa trị trong phân tử hydrogen và oxygen.
Trả lời:
- Quá trình tạo thành liên kết cộng hóa trị trong phân tử hydrogen:
+ Nguyên tử H chỉ có 1 electron và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
+ Khi hai nguyên tử H liên kết với nhau, mỗi nguyên tử góp chung 1 electron để tạo ra đôi electron dùng chung.
+ Hạt nhân của hai nguyên tử H cùng hút đôi electron dùng chung và liên kết với nhau tạo thành phân tử hydrogen.
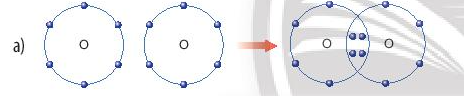
 - Quá trình tạo thành liên kết cộng hóa trị trong phân tử oxygen:
- Quá trình tạo thành liên kết cộng hóa trị trong phân tử oxygen:
+ Nguyên tử O có 6 electron lớp ngoài cùng, cần thêm 2 electron để có lớp vỏ bền vững tương tự khí hiếm.
+ Khi hai nguyên tử O liên kết với nhau, mỗi nguyên tử góp 2 electron để tạo ra hai cặp electron dùng chung.
+ Hạt nhân của hai nguyên tử O cùng hút các cặp electron dùng chung và liên kết với nhau tạo thành phân tử oxygen.
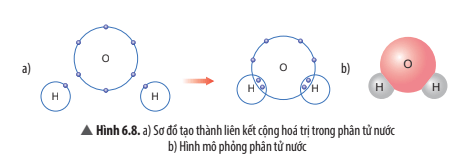
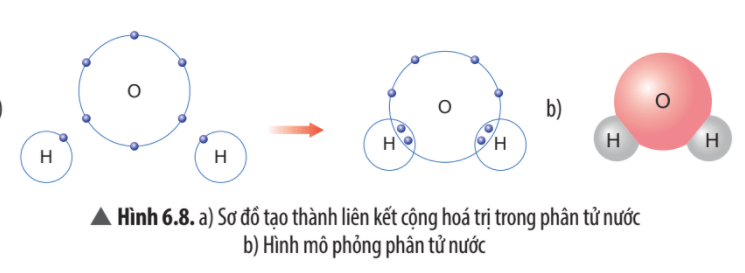
Câu hỏi thảo luận 8 trang 41 KHTN lớp 7: Quan sát Hình 6.8, em hãy cho biết số electron dùng chung của nguyên tử H và nguyên tử O. Trong phân tử nước, số electron ở lớp ngoài cùng của O và H là bao nhiêu và giống với khí hiếm nào?
Trả lời:
- Mỗi nguyên tử H góp chung 1 electron, nguyên tử O góp chung 1 electron với mỗi nguyên tử H. Trong phân tử nước có 2 nguyên tử H, vậy nguyên tử O góp chung 2 electron với 2 nguyên tử H.
- Trong phân tử nước, số electron ở lớp ngoài cùng của O là 8 electron giống với khí hiếm neon (Ne).
Trong phân tử nước, số electron ở lớp ngoài cùng của H là 2 electron giống với khí hiếm helium (He),
Câu hỏi thảo luận 9 trang 41 KHTN lớp 7: Em hãy mô tả quá trình tạo thành liên kết cộng hóa trị trong phân tử nước.
Trả lời:
Khi tạo thành phân tử nước, nguyên tử O góp 2 electron, mỗi nguyên tử H góp 1 electron. Như vậy, giữa nguyên tử O và nguyên tử H có 1 đôi electron dùng chung. Hạt nhân nguyên tử O và H cùng hút đôi electron dùng chung, liên kết với nhau tạo ra phân tử nước.
Luyện tập trang 41 KHTN lớp 7: Vẽ sơ đồ hình thành liên kết cộng hóa trị trong các phân tử sau
Trả lời:
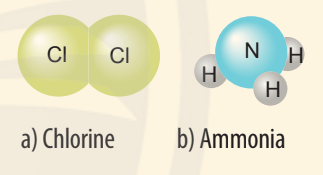
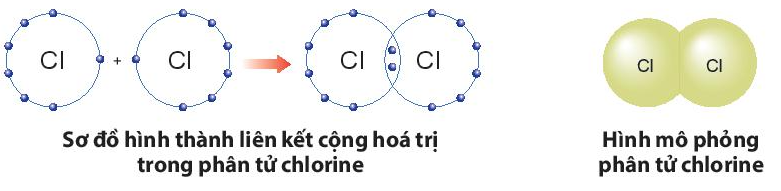
a) Sự hình thành liên kết trong phân tử chlorine:
- Nguyên tử Cl có 7 electron lớp ngoài cùng, cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
- Khi hai nguyên tử Cl liên kết với nhau, mỗi nguyên tử góp 1 electron để tạo ra đôi electron dùng chung.
- Hạt nhân của hai nguyên tử Cl cùng hút đôi electron dùng chung và liên kết với nhau tạo thành phân tử chlorine.
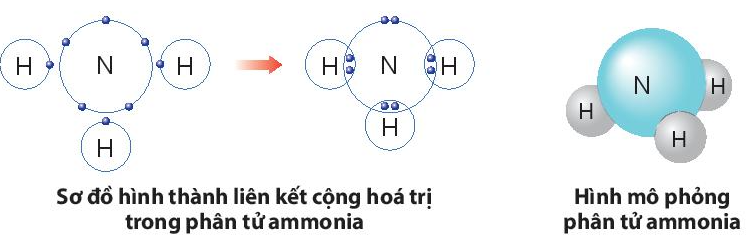
b) Sự hình thành liên kết trong phân tử ammonia.
- Nguyên tử N có 5 electron lớp ngoài cùng, cần thêm 3 electron để có lớp vỏ bền vững tương tự khí hiếm.
- Nguyên tử H chỉ có 1 electron và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
- Khi tạo thành phân tử NH3, nguyên tử N góp 3 electron, mỗi nguyên tử H góp 1 electron. Như vậy giữa nguyên tử N và mỗi nguyên tử H có 1 đôi electron dùng chung. Hạt nhân nguyên tử N và H cùng hút đôi electron dùng chung, liên kết với nhau tạo ra phân tử ammonia.
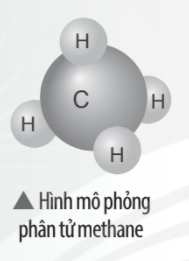
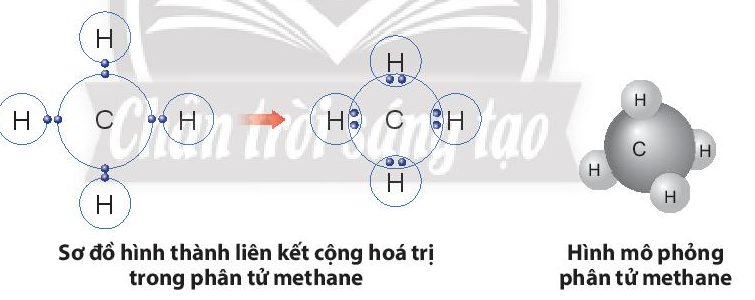
Vận dụng trang 41 KHTN lớp 7: Khí methane là thành phần chính của khí thiên nhiên và khí mỏ dầu. Khí này còn được tạo ra từ hầm biogas. Methane là nguồn nhiên liệu quan trọng trong đời sống và có nhiều ứng dụng trong công nghiệp. Em hãy vẽ sơ đồ hình thành liên kết trong phân tử methane và liệt kê một số ứng dụng của nó thông qua tìm hiểu trên sách báo, internet, …
Trả lời:
Sự hình thành liên kết trong phân tử methane:
- Nguyên tử C có 4 electron lớp ngoài cùng, cần thêm 4 electron để có lớp vỏ bền vững tương tự khí hiếm.
- Nguyên tử H chỉ có 1 electron và cần thêm 1 electron để có lớp vỏ bền vững tương tự khí hiếm.
- Khi C kết hợp với H, nguyên tử C góp 4 electron, mỗi nguyên tử H góp 1 electron. Như vậy giữa nguyên tử C và mỗi nguyên tử H có 1 đôi electron dùng chung. Hạt nhân nguyên tử C và H cùng hút đôi electron dùng chung, liên kết với nhau tạo ra phân tử methane.
- Ứng dụng của methane:
+ Làm nhiên liệu đun nấu thay cho các nhiên liệu khác, thắp sáng.
+ Trong công nghiệp: dùng trong nhiều phản ứng hóa công nghiệp; làm nguyên liệu sản xuất hydrogen, methanol, acetic acid và acetic anhydride.
4. Chất ion, chất cộng hóa trị
Câu hỏi thảo luận 10 trang 41 KHTN lớp 7: Cho biết mỗi phân tử của chất trong Hình 6.9 được tạo bởi các ion nào? Ở điều kiện thường, các chất này ở thể gì?

Trả lời:
Hình 6.9 a) Phân tử sodium chloride (NaCl) được tạo bởi ion Na+ và Cl-;
Hình 6.9 b) Phân tử calcium chloride (CaCl2) được tạo bởi ion Ca2+ và Cl-;
Hình 6.9 c) Phân tử magnesium oxide (MgO) được tạo bởi ion Mg2+ và O2-;
Ở điều kiện thường, các chất này đều tồn tại ở thể rắn.
Câu hỏi thảo luận 11 trang 42 KHTN lớp 7: Quan sát và cho biết thể của các chất có trong Hình 6.10.
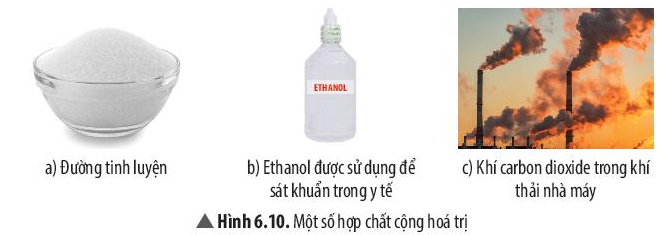
Trả lời:
- Hình 6.10 a) Đường tinh luyện ở thể rắn.
- Hình 6.10 b) Ethanol ở thể lỏng.
- Hình 6.10 c) Carbon dioxide ở thể khí.
Câu hỏi thảo luận 12 trang 42 KHTN lớp 7: Nêu một số ví dụ về chất cộng hóa trị và cho biết thể của chúng ở điều kiện thường.
Trả lời:
- Thể rắn: iodine, nước đá khô, …
- Thể lỏng: nước; ethanol; bromine …
- Thể khí: nitrogen; chlorine; sulfur dioxide …
Luyện tập trang 42 KHTN lớp 7: Khói của núi lửa ngầm phun trào từ dưới biển có chứa một số chất như: hơi nước, sodium chloride, potassium chloride, carbon dioxide, sulfur dioxide.
a) Hãy cho biết chất nào là hợp chất ion, chất nào là hợp chất cộng hóa trị.
b) Nguyên tử của nguyên tố nào trong các chất trên có số electron ở lớp ngoài cùng nhiều nhất?

Trả lời:
a) Chất ion: sodium chloride (NaCl), potassium chloride (KCl);
Chất cộng hóa trị: hơi nước (H2O), carbon dioxide (CO2), sulfur dioxide (SO2)
b) Trong các chất trên nguyên tử của chlorine (Cl) có số electron ở lớp ngoài cùng nhiều nhất với 7 electron.
5. Một số tính chất của chất ion và chất cộng hóa trị
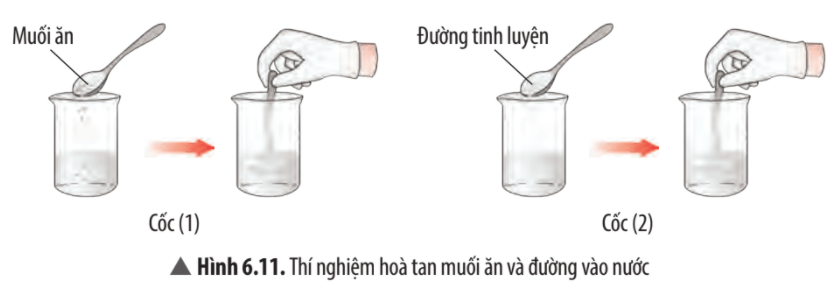
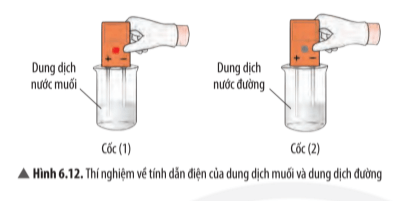
Câu hỏi thảo luận 13 trang 42 KHTN lớp 7: Quan sát thí nghiệm 1 (Hình 6.11, 6.12) và đánh dấu để hoàn thành bảng sau:
|
Tính chất |
Muối |
Đường |
|
Tan trong nước |
? |
? |
|
Dẫn điện được |
? |
? |
Trả lời:
|
Tính chất |
Muối |
Đường |
|
Tan trong nước |
√ |
√ |
|
Dẫn điện được |
√ |
|
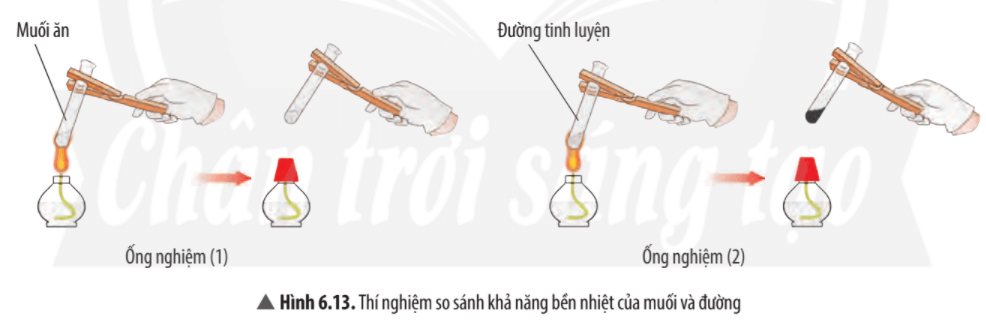
Câu hỏi thảo luận 14 trang 43 KHTN lớp 7: Quan sát thí nghiệm 2 (Hình 6.13), cho biết muối hay đường bền nhiệt hơn. Ở ống nghiệm nào có sự tạo thành chất mới?
Trả lời:
Quan sát thí nghiệm ta thấy muối ăn không bị nhiệt phân hủy (không bị biến đổi khi đun), đường bị nhiệt phân hủy thành chất mới có màu đen.
⇒ Muối ăn bền với nhiệt hơn đường.
Mở rộng: Đường nóng chảy ở 186oC, muối ăn (sodium chloride) nóng chảy ở 810oC. Ở thí nghiệm này nếu tăng thêm thời gian đun nóng, muối rắn sẽ nóng chảy ra thành lỏng. Tính chất này vẫn là tính chất vật lí.
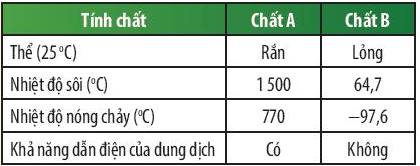
Luyện tập trang 44 KHTN lớp 7: Kết quả thử nghiệm tính chất của 2 chất A và B được trình bày ở bảng bên. Em hãy cho biết chất nào là chất cộng hóa trị, chất nào là chất ion?
Trả lời:
Dựa vào kết quả được trình bày ở bảng trên ta thấy: Chất A có nhiệt độ sôi và nhiệt độ nóng chảy cao hơn rất nhiều so với chất B, chất A tồn tại ở thể rắn và dung dịch chất A có khả năng dẫn điện, dung dịch chất B không có khả năng dẫn điện.
⇒ Chất A là hợp chất ion, chất B là chất cộng hóa trị.
Dự đoán chất A có thể là potassium chloride; chất B có thể là methanol.
Vận dụng trang 44 KHTN lớp 7: Khi cơ thể bị mất nước do tiêu chảy, nôn mửa, …người ta thường cho bệnh nhân uống dung dịch oresol. Tìm hiểu qua sách báo và internet, hãy cho biết thành phần của oresol có các loại chất nào (chất ion, chất cộng hóa trị)?
Trong trường hợp không có oresol thì có thể thay thế bằng cách nào khác không? Giải thích.
Trả lời:
Thành phần chính của oresol:
- Các hợp chất ion: Sodium chloride (NaCl); potassium chloride…
- Hợp chất cộng hóa trị: glucose.
 Một số loại oresol
Một số loại oresol
Công dụng chính của osresol là bổ sung nước và các chất điện giải cho cơ thể.
Trong trường hợp không có oresol thì có thể thay thế bằng:
- Nước muối đường: Có thành phần tương tự như oresol. Pha theo tỷ lệ 1 thìa cà phê muối, 8 thìa đường và 1 lít nước.
- Nước cháo muối (1,2 lít nước, 1 thìa muối, 1 nắm gạo), đồng thời uống bổ sung nước dừa, nước cam, ăn thêm chuối để bổ sung thêm potassium.
Bài tập (trang 44)
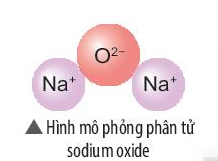
Bài 1 trang 44 KHTN lớp 7: Hãy vẽ sơ đồ và mô tả quá trình tạo thành liên kết trong phân tử sodium oxide (hình bên).
Trả lời:
Sự tạo thành liên kết trong phân tử sodium oxide (Na2O)
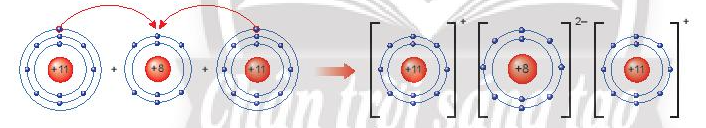
Khi nguyên tử sodum (Na) kết hợp với nguyên tử oxygen (O), 2 nguyên tử sodium mỗi nguyên tử nhường 1 electron tạo thành ion dương, kí hiệu là Na+, đồng thời nguyên tử oxygen (O) nhận 2 electron từ nguyên tử Na tạo thành ion âm, kí hiệu O2-. Hai ion Na+ và O2- hút nhau tạo phân tử sodium oxide (Na2O).
Bài 2 trang 44 KHTN lớp 7: Cho biết vị trí trong bảng tuần hoàn, số electron lớp ngoài cùng của nguyên tử mỗi nguyên tố N, C, O và vẽ sơ đồ hình thành liên kết trong các phân tử ở hình sau:
Trả lời:
Vị trí trong bảng tuần hoàn, số electron lớp ngoài cùng của nguyên tử mỗi nguyên tố N, C, O được xác định theo bảng sau:
|
Nguyên tố |
Vị trí các nguyên tố trong bảng tuần hoàn |
Số electron lớp ngoài cùng |
|
N |
Ô thứ 7, chu kì 2, nhóm VA |
5 |
|
C |
Ô thử 6, chu kì 2, nhóm IVA |
4 |
|
O |
Ô thử 8, chu kì 2, nhóm VIA |
6 |
Sự tạo thành liên kết trong phân tử nitrogen:
+ Nguyên tử N có 5 electron lớp ngoài cùng, cần thêm 3 electron để có lớp vỏ bền vững tương tự khí hiếm.
+ Khi hai nguyên tử N liên kết với nhau, mỗi nguyên tử góp chung 3 electron để tạo ra 3 cặp electron dùng chung, theo sơ đồ sau:
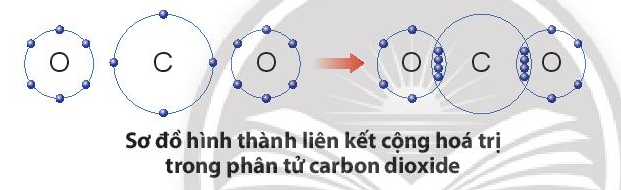
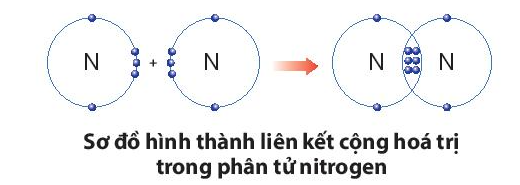 Sự tạo thành liên kết trong phân tử carbon dioxide:
Sự tạo thành liên kết trong phân tử carbon dioxide:
+ Nguyên tử C có 4 electron ở lớp ngoài cùng và cần thêm 4 electron để đạt được lớp vỏ bền vững tương tự khí hiếm Ne.
+ Trong phân tử khí carbon dioxide, nguyên tử C góp 4 electron, mỗi nguyên tử O góp 2 electron. Như vậy, giữa nguyên tử C và O có hai đôi electron dùng chung theo sơ đồ sau:
 Bài 3 trang 44 KHTN lớp 7: Potassium chloride là hợp chất có nhiều ứng dụng trong đời sống. Trong nông nghiệp, nó được dùng làm phân bón. Trong công nghiệp, potassium chloride được dùng làm nguyên liệu để sản xuất potassium hydroxide và kim loại potassium. Trong y học, potassium chloride được dùng để bào chế thuốc điều trị bệnh thiếu kali trong máu. potassium chloride rất cần thiết cho cơ thể, trong các chức năng hoạt động của hệ tiêu hóa, tim, thận, cơ và cả hệ thần kinh.
Bài 3 trang 44 KHTN lớp 7: Potassium chloride là hợp chất có nhiều ứng dụng trong đời sống. Trong nông nghiệp, nó được dùng làm phân bón. Trong công nghiệp, potassium chloride được dùng làm nguyên liệu để sản xuất potassium hydroxide và kim loại potassium. Trong y học, potassium chloride được dùng để bào chế thuốc điều trị bệnh thiếu kali trong máu. potassium chloride rất cần thiết cho cơ thể, trong các chức năng hoạt động của hệ tiêu hóa, tim, thận, cơ và cả hệ thần kinh.
Hợp chất potassium chloride có loại liên kết gì trong phân tử? Vẽ sơ đồ hình thành liên kết có trong phân tử này.

Trả lời:
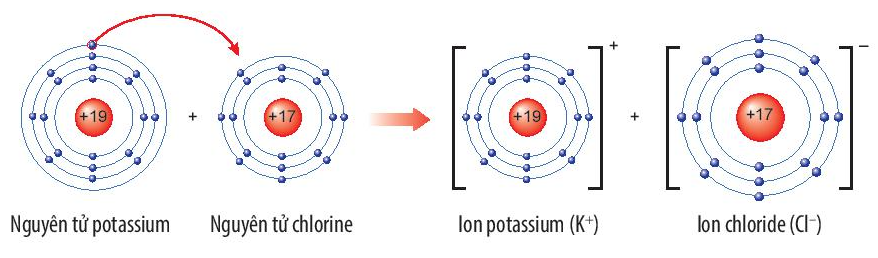
Hợp chất potassium chloride (KCl) có liên kết ion trong phân tử.
Sự hình thành liên kết trong phân tử potassium chloride
+ Nguyên tử K nhường đi 1 electron ở lớp ngoài cùng trở thành ion potassium, mang điện tích dương, kí hiệu là K+.
+ Nguyên tử Cl nhận 1 electron từ nguyên tử K trở thành ion chlorine, mang điện tích âm, kí hiệu là Cl-.
Các ion K+ và Cl- hút nhau tạo thành liên kết trong phân tử potassium chloride.
Xem thêm lời giải bài tập Khoa học tự nhiên lớp 7 Chân trời sáng tạo hay, chi tiết khác:
Giải Khoa học tự nhiên 7 Bài 7: Hóa trị và công thức hóa học
Giải Khoa học tự nhiên 7 Bài 8: Tốc độ chuyển động
Giải Khoa học tự nhiên 7 Bài 9: Đồ thị quãng đường - thời gian - Kết nối tri thức
Giải Khoa học tự nhiên 7 Bài 10: Đo tốc độ - Kết nối tri thức
Giải Khoa học tự nhiên 7 Bài 11: Tốc độ và an toàn giao thông - Kết nối tri thức