[Năm 2021] Đề thi Giữa kì 1 Hóa học lớp 10 có ma trận chi tiết (15 đề)
Đề thi Hóa Học lớp 10 Giữa học kì 1 năm 2021 có ma trận (15 đề) được tổng hợp, cập nhật mới nhất từ đề thi môn Toán 10 của các trường THPT trên cả nước. Thông qua việc luyện tập với đề thi Toán lớp 10 Giữa học kì 1 này sẽ giúp các em học sinh hệ thống kiến thức đã học, ôn luyện để đạt điểm cao trong các bài thi môn Toán 10. Chúc các em học tốt!
[Năm 2021] Đề thi Giữa kì 1 Hóa học lớp 10 có ma trận chi tiết (15 đề)
MA TRẬN THAM KHẢO THI GIỮA KÌ I – HÓA HỌC 10 – NĂM 2021 -2022
|
CHƯƠNG |
CHUYÊN ĐỀ |
Nhận biết |
Thông hiểu |
Vận dụng |
Vận dụng cao |
Tổng |
|||||||
|
TN |
TL |
TN |
TL |
TN |
TL |
TN |
TL |
TN |
TL |
Toàn bộ |
|||
|
NGUYÊN |
1 |
Thành phần nguyên tử |
2 |
1 |
3 |
0 |
|||||||
|
0,5 |
0 |
0,5 |
0,25 |
0 |
0,75 |
0,5 |
1,25 |
||||||
|
2 |
Hạt nhân nguyên tử - |
1 |
1 |
1 |
3 |
0 |
|||||||
|
0,25 |
0,25 |
0,5 |
0,25 |
0 |
0,75 |
0,5 |
1,25 |
||||||
|
3 |
Vỏ nguyên tử - |
2 |
2 |
4 |
0 |
||||||||
|
0,5 |
0,5 |
0,5 |
0 |
0 |
1 |
0,5 |
1,5 |
||||||
|
BẢNG |
4 |
Cấu tạo bảng tuần hoàn |
2 |
1 |
1 |
4 |
0 |
||||||
|
0,5 |
0,5 |
0,25 |
0,25 |
0 |
1 |
0,5 |
1,5 |
||||||
|
5 |
Sự biến đổi cấu hình e, |
1 |
1 |
2 |
0 |
||||||||
|
0,25 |
0,5 |
0 |
0,5 |
0,25 |
0,5 |
0 |
0,5 |
0,5 |
2 |
2,5 |
|||
|
6 |
Ý nghĩa bảng tuần hoàn |
1 |
1 |
2 |
0 |
||||||||
|
0 |
0,5 |
0 |
0,5 |
0,25 |
0,25 |
0,5 |
1 |
1,5 |
|||||
|
TỔNG |
7 |
Tổng hợp kiến thức |
1 |
1 |
2 |
0 |
|||||||
|
0 |
0 |
0,25 |
0,25 |
0,5 |
0 |
0,5 |
|||||||
|
TỔNG |
8 |
0 |
4 |
0 |
6 |
0 |
2 |
0 |
20 |
0 |
0 |
||
|
2 |
2 |
1 |
2 |
1,5 |
0,5 |
0,5 |
0,5 |
5 |
5 |
10 |
|||
|
4 |
3 |
2 |
1 |
||||||||||
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1
Năm học 2021 - 2022
Bài thi môn: Hóa Học lớp 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 1)
Cho: Na = 23, O = 16, C = 12, H = 1, Cu = 64, Fe = 56, S = 32, Br = 80
Khoanh tròn vào chữ cái đặt trước câu trả lời đúng nhất (0,4 điểm)
Câu 1. Phát biểu nào dưới đây không đúng?
A. Nguyên tử trung hòa về điện
B. Hạt nhân mang điện tích dương
C. Khối lượng nguyên tử tập trung ở hạt nhân
D. Nguyên tử có cấu trúc đặc khít.
Câu 2. Dãy nào sau đây gồm các phân lớp electron đã bão hòa?
A. s1, p2, d8, f12 B.s2, p5, d9, f11 C. s2, p5, d9, f13 D. s2, p6, d10, f14
Câu 3. Cấu hình electron nguyên tử của hai nguyên tố X, Y lần lượt là: 1s22s22p63s2 và 1s22s22p63s23p4. Kết luận nào sau đây đúng?
A. X, Y đều là kim loại.
B. X là kim loại, Y là phi kim.
C. X là phi kim, Y là kim loại.
D. X, Y đều là phi kim.
Câu 4. Trong nguyên tử, hạt mang điện tích âm là
A. electron.
B. proton và electron.
C. proton
D. nơtron
Câu 5. Nguyên tử của nguyên tố R có 3 lớp electron, lớp ngoài cùng có 5 electron. Số hiệu nguyên tử của R là
A. 15. B. 16 C. 14 D. 19
Câu 6. Nguyên tử Zn có kí hiệu hóa học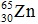 .Số nơtron của nguyên tử là:
.Số nơtron của nguyên tử là:
A. 30 B. 65 C. 35 D. 15
Câu 7. Bo có hai đồng vị 10B và 11B với nguyên tử khối trung bình là 10,81. Xem nguyên tử khối mỗi đồng vị có giá trị bằng số khối. Phần trăm số nguyên tử đồng vị 11B là
A. 81%. B. 40,5% C. 19% D. 59,5%.
Câu 8. Cấu hình electron không đúng là
A. 1s22s22p6.
B. 1s22s22p63s23p4.
C. 1s22s22p63s23p34s2.
D. 1s22s22p63s1
Câu 9. Nguyên tử của nguyên tố hóa học nào sau đây có cấu hình electron là: 1s22s22p63s23p4
A. P B. Cl C. S D. Si
Câu 10. Phân tử X2Y có tổng số hạt mang điện là 44. Số hạt mang điện của X bằng 4/3 lần số hạt mang điện của Y. Cấu hình electron của Y là
A. 1s22s22p2 B. 1s22s22p3 C. 1s22s22p4 D. 1s22s22p5
Câu 11. Nguyên tử X có tổng số hạt proton, nơtron, electron là 34. Biết số nơtron nhiều hơn số proton là 1. Số khối của X là:
A. 19 B. 23 C. 21 D. 11
Câu 12. Một nguyên tố hoá học X ở chu kỳ 3, nhóm VA. Cấu hình electron của nguyên tử X là
A. 1s22s22p63s23p2
B. 1s22s22p63s23p5
C. 1s22s22p63s23p3
D. 1s22s22p63s23p4
Câu 13. Cấu hình e của : 1s22s22p63s23p64s1. Vậy kết luận nào sau đây sai?
A. Là nguyên tố mở đầu chu kỳ 4.
B. Thuộc chu kỳ 4, nhóm IA.
C. Có 20 notron trong hạt nhân.
D. Nguyên tử có 7e ở lớp ngoài cùng.
Câu 14. X, Y là 2 nguyên tố liên tiếp nhau trong một nhóm A và có tổng số hiệu nguyên tử là 27 (Zx < Zy ). Số hiệu nguyên tử của X, Y lần lượt là:
A. 11,16 B. 12,13 C. 9,18 D. 10,17
Câu 15. Cho dãy các nguyên tố nhóm IA: Li-Na- K- Rb- Cs. Từ Li đến Cs, theo chiều tăng điện tích hạt nhân, tính kim loại thay đổi theo chiều nào?
A. Giảm dần.
B. Giảm rồi tăng.
C. Tăng dần.
D. Tăng rồi giảm.
Câu 16. Hòa tan hoàn toàn 0,3 gam hỗn hợp hai kim loại X và Y ở hai chu kì liên tiếp của nhóm IA vào nước thì thu được 0,224 lít khí hiđro (đktc), X và Y là những nguyên tố hóa học nào sau đây?
A. Li và Na B. Rb và Cs C. Na và K D. K và Rb.
Câu 17. Một nguyên tố R có 3 đồng vị X, Y, Z biết tổng số các hạt proton, nơtron, electron trong 3 đồng vị bằng 129, số nơtron trong đồng vị X hơn đồng vị Y một hạt, còn trong đồng vị Z có proton bằng số nơtron. Số khối của đồng vị X là
A. 27 B. 28 C. 30 D. 29
Câu 18. Nguyên tố có cấu hình electron hóa trị 3d54s2 ở vị trí nào trong bảng tuần hoàn?
A. chu kì 4, nhóm VIA.
B. chu kì 4, nhóm VIIA.
C. chu kì 5, nhóm IIA.
D.chu kì 4, nhóm VIIB.
Câu 19. Cho các nguyên tử Na; K; Mg. Thứ tự giảm dần bán kính của các nguyên tử trên là
A. Na < Mg < K
B. K < Mg < Na
C. Mg < Na < K
D. K < Na < Mg
Câu 20. Trong một phân nhóm chính, theo chiều tăng dần của điện tích hạt nhân
A. bán kính nguyên tử giảm dần, tính kim loại tăng dần.
B. bán kính nguyên tử giảm dần, tính phi kim tăng dần.
C. bán kính nguyên tử tăng dần, tính phi kim tăng dần.
D. bán kính nguyên tử tăng dần, tính phi kim giảm dần
Câu 21. Ion R3+ có cấu hình electron lớp ngoài cùng là: 2s22p6. Nguyên tố M là :
A. Mg B. Na C. Al D. K
Câu 22. Hợp chất khí với H của nguyên tố Y là YH4. Oxit cao nhất của nó chứa 46,67%Y về khối lượng. Nguyên tố Y là
A. Lưu huỳnh
B. Silic
C. Cacbon
D. Natri
Câu 23. Trong các phát biểu sau, phát biểu nào đúng:
A. Trong nguyên tử: số proton = số nơtron= số đơn vị điện tích hạt nhân
B. Tổng số proton và số electron được gọi là số khối.
C. Số khối là khối lượng tuyệt đối của nguyên tử.
D. Đồng vị là các nguyên tử có cùng số proton nhưng khác số nơtron nên số khối khác nhau.
Câu 24. Cho 3,9g một kim loại kiềm, tác dụng hết với dung dịch HCl dư thu được 1,12 lit khí hiđro ( ở đktc ). Kim loại đó là :
A. Na B. K C. Mg D. Li
Câu 25. Anion X2− có cấu hình electron là 1s22s22p6. Số electron lớp ngoài cùng của X là
A. 6 B. 4 C. 2 D. 1

-----------------------------------------------------------------------------------------------------------------------
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1
Năm học 2021 - 2022
Bài thi môn: Hóa Học lớp 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 2)
Câu 1: Nguyên tử luôn trung hoà điện nên
A. tổng số hạt nơtron luôn bằng tổng số hạt electron.
B. tổng số hạt nơtron luôn bằng tổng số hạt proton.
C. tổng số hạt electron luôn bằng tổng số hạt proton.
D. tổng số hạt nơtron và proton luôn bằng tổng số hạt electron.
Câu 2: Số e tối đa có trong các phân lớp s, p, d lần lượt là
A. 6; 2; 10. B. 2; 6; 10. C. 10; 6; 2. D. 6; 10; 14.
Câu 3: Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử là
A. proton và nơtron. B. proton và electron.
C. electron và nơtron. D. electron, proton và nơtron.
Câu 4: Cho các cấu hình electron nguyên tử của các nguyên tố sau:
(X) 1s22s22p63s23p1
(Y) 1s22s22p63s23p63d54s2
(Z) 1s22s22p63s23p6
(T) 1s22s22p63s2.
Các nguyên tố s là
A. T. B. Y, T. C. X, Y, T D. Y, Z, T.
Câu 5: Magie có 3 đồng vị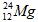 ( 79%),
( 79%),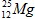 ( 10%), còn lại là
( 10%), còn lại là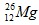 . Nguyên tử khối trung bình của Mg là
. Nguyên tử khối trung bình của Mg là
A. 24,32. B. 24,23. C. 21,46. D. 12,00.
Câu 6: Các mệnh đề dưới đây, mệnh đề nào đúng?
A. Đồng vị là những nguyên tử có cùng điện tích hạt nhân nhưng khác nhau về số electron.
B. Đồng vị là những nguyên tử có cùng số nơtron nhưng khác về số proton.
C. Đồng vị là những nguyên tử có cùng điện tích hạt nhân nhưng khác nhau về số nơtron.
D. Đồng vị là những nguyên tử có cùng số khối nhưng khác về số nơtron.
Câu 7: Có 3 nguyên tử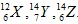 :Những nguyên tử nào là các đồng vị của một nguyên tố?
:Những nguyên tử nào là các đồng vị của một nguyên tố?
A. Y và Z. B. X và Y. C. X,Y và Z. D. X và Z.
Câu 8: Nguyên tử N (Z = 7) ở trạng thái cơ bản có bao nhiêu e ở lớp ngoài cùng?
A. 5. B. 8. C. 4. D. 7.
Câu 9: Bán kính của 1 nguyên tử H là 0,53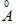 và MH =1,0079u. Khối lượng riêng (g/cm3) của nguyên tử hiđro là
và MH =1,0079u. Khối lượng riêng (g/cm3) của nguyên tử hiđro là
A. 8,74. B. 7,48. C. 4,78. D. 2,69.
Câu 10: Nguyên tử X có 3 lớp e, lớp ngoài cùng chứa 7e. Nguyên tử X có cấu hình electron là
A. 1s22s12p6. B. 1s12s22p5.
C. 1s22s22p63s23p5. D. 1s22s22p5.
Câu 11: Cấu hình electron nguyên tử crom (Z = 24) là
A. 1s22s22p63s23p63d54s1. B. 1s22s22p63s23p64s13d5.
C. 1s22s22p63s23p63d44s2. D. 1s22s22p63s23p64s23d4.
Câu 12: Nguyên tố hóa học là những nguyên tử có cùng
A. số khối. B. số proton.
C. số nơtron. D. số proton và nơtron.
Câu 13: Hạt nhân nguyên tử nào sau đây có số hạt nơtron là 28?
A.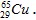 B.
B.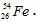 C.
C.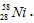 D.
D.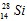
Câu 14: Điện tích của một hạt nơtron trong nguyên tử bằng
A. qn = 2+. B. qn = 1-. C. qn = 1+. D. qn = 0.
Câu 15: Nguyên tử nguyên tố X có 11electron, 11proton, 12 nơtron. Số khối của hạt nhân nguyên tử X là
A. 23. B. 34. C. 12. D. 22.
Câu 16: Số electron tối đa của lớp K là
A. 18. B. 10. C. 2. D. 8.
Câu 17: Cho cấu hình electron nguyên tử của các nguyên tố:
X: 1s22s22p63s2
Y: 1s22s22p63s23p4
Z: 1s22s22p63s23p63d104s24p6
A. X là kim loại, Y là phi kim, Z là khí hiếm.
B. X là kim loại,Y là kim loại,Z là khí hiếm.
C. X là phi kim ,Y là kim loại, Z là khí hiếm.
D. X là phi kim, Y là khí hiếm, Z là kim loại.
Câu 18: Cấu hình e nguyên tử sắt là 1s22s22p63s23p63d64s2. Lớp M trong vỏ nguyên tử chứa bao nhiêu e?
A. 8. B. 14. C. 2. D. 26.
Câu 19: Electron thuộc lớp nào sau đây liên kết chặt chẽ nhất với hạt nhân và có mức năng lượng thấp nhất?
A. Lớp L. B. Lớp N. C. Lớp M. D. Lớp K.
Câu 20: Kí hiệu hóa học biểu thị đầy đủ đặc trưng cho nguyên tử của nguyên tố hóa học vì nó cho biết
A. nguyên tử khối của nguyên tử. B. số khối
C. số hiệu nguyên tử Z. D. số khối A và số hiệu nguyên tử Z.
Câu 21: Một nguyên tử M có 26 electron và 30 nơtron. Kí hiệu nguyên tử M là
A.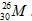 . B.
. B.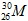 . C.
. C.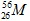 . D.
. D.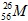 .
.
Câu 22: Hiđro có 3 đồng vị H, H, H số kiểu phân tử H2 có thể tạo thành là?
A. 2. B. 3. C. 6. D. 5.
Câu 23: Nguyên tử nguyên tố X có tổng số hạt mang điện là 32, số hạt không mang điện nhiều hơn số hạt mang điện âm là 1 hạt. Viết kí hiệu nguyên tử X.
A. 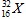 . B.
. B.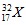 . C.
. C.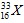 . D.
. D.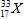 .
.
Câu 24: Trong tự nhiên X có 2 đồng vị là X1 và X2. Cho biết tỉ lệ số nguyên tử của X1 và X2 lần lượt là 73 : 27. X2 có số khối là 65 và X1 có ít hơn X2 2 hạt nơtron. Tính nguyên tử khối trung bình của X.
A. 64,32. B. 65,32. C. 64,00. D. 63,54.
Câu 25: Nguyên tử khối trung bình của brom là = 79,91. Biết brom có 2 đồng vị: chiếm 54,5% số nguyên tử. Số khối của đồng vị còn lại là
A. 80. B. 82. C. 79. D. 81.
Câu 26: Trong số các nguyên tử sau, chọn nguyên tử có số nơtron nhỏ nhất.
A. . B.
. B.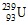 . C.
. C.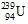 . D.
. D.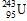 .
.
Câu 27: Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố Y cũng có electron ở mức năng lượng 3p và có một electron ở lớp ngoài cùng. Nguyên tử X và Y có số electron hơn kém nhau là 2. Nguyên tố X, Y lần lượt là
A. kim loại và kim loại. B. kim loại và khí hiếm.
C. phi kim và kim loại. D. khí hiếm và kim loại.
Câu 28: Nguyên tử nguyên tố X có tổng số electron trên phân lớp p là 10. Số hiệu nguyên tử nguyên tố X là
A. 15. B. 17. C. 16. D. 10.
Câu 29: Nguyên tử R tạo được cation R+. Cấu hình electron ở phân lớp ngoài cùng của R+ (ở trạng thái cơ bản) là 2p6. Tổng số hạt mang điện trong nguyên tử R là
A. 23. B. 22. C. 11. D. 10.
Câu 30: Cho 4,6 gam một kim nhóm IA tác dụng hết với nước thu được 2,24 lít (ở điều kiện tiêu chuẩn) H2 thoát ra. Kim loại đó là
A. 23Na. B. 39K. C. 40Ca. D. 7Li.
-----------------------------------------------------------------------------------------
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1
Năm học 2021 - 2022
Bài thi môn: Hóa Học lớp 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 3)
Cho biết nguyên tử khối: H (1); He (4); Li (7); C (12); N (14); O (16); Na (23); Mg (24); Ba (137); Al (27), P (31); S (32); Cl (35,5); K (39); Ca (40); Cr (52); Fe (56); Cu (64); Zn (65); Ag(108); Br(80).
Phần I: Trắc nghiệm (4,0 điểm)
Câu 1: Các hạt cấu tạo nên hạt nhân của hầu hết nguyên tử là:
A. electron, proton và nơtron B. electron và nơtron
C. proton và nơtron D. electron và proton
Câu 2: Nguyên tố hóa học là những nguyên tử có cùng
A. số nơtron và proton. B. số nơtron.
C. số proton. D. số khối.
Câu 3: Nguyên tử Na (Z = 11) có số lớp electron là
A. 3. B. 2. C. 1. D. 4.
Câu 4: Cho nguyên tử Ca (Z = 20) hãy cho biết nguyên tử đó là:
A. Kim loại B. Phi kim C. Khí hiếm D. Lưỡng tính.
Câu 5: Nếu hạt nhân nguyên tử có Z hạt proton thì
A. Số đơn vị điện tích hạt nhân là Z+
B. Điện tích hạt nhân là Z
C. Số hạt notron là Z
D. Tổng số hạt mang điện trong nguyên tử là 2Z
Câu 6: Một nguyên tử X có tổng số electron ở các phân lớp s là 6 và tổng số electron ở lớp ngoài cùng cũng là 6, cho biết X là nguyên tố hóa học nào sau đây?
A. O (Z = 8). B. S (Z = 16).
C. Fe (Z = 26). D. Cr (Z = 24).
Câu 7: Nguyên tố X thuộc chu kì 3, nhóm IIIA. Cấu hình electron của nguyên tử X là
A. 1s22s22p4 B. 1s22s22p63s23p4
C. 1s22s22p63s23p1 D. 1s22s22p63s23p3
Câu 8: Nguyên tử của nguyên tố X có electron cuối cùng được điền vào phân lớp 4s1. Nguyên tử của nguyên tố Y có electron cuối cùng được điền vào phân lớp 3p3. Số proton của X và Y lần lượt là
A. 15 và 19. B. 19 và 14. C. 18 và 15. D. 19 và 15.
Câu 9: Cation M2+ có cấu hình e phân lớp ngoài cùng là 2p6, cấu hình e của nguyên tử M là
A. 1s22s22p6 B. 1s22s22p63s1 C. 1s22s22p63s2 D. 1s22s22p4
Câu 10: Cho nguyên tố hóa học có kí hiệu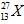 . Trong nguyên tử X có
. Trong nguyên tử X có
A. 13 hạt proton, 14 hạt nơtron. B. 13 hạt nơtron, 14 hạt proton.
C. 13 hạt proton, 27 hạt nơtron. D. 13 hạt nơtron, 27 hạt proton.
Câu 11: Cấu hình e của nguyên tử X: 1s22s22p63s23p3. Hợp chất với hiđro và oxit cao nhất của X có dạng là
A. HX, X2O7 B. H2X, XO3
C. XH4, XO2 D. H3X, X2O5
Câu 12: Phát biểu nào sau đây là sai:
A. Số hiệu nguyên tử bằng số đơn vị điện tích hạt nhân nguyên tử.
B. Số proton trong nguyên tử bằng số nơtron.
C. Số proton trong hạt nhân bằng số electron ở lớp vỏ nguyên tử.
D. Số khối của hạt nhân nguyên tử bằng tổng số hạt proton và số hạt nơtron.
Câu 13: Tổng số các loại hạt cơ bản trong nguyên tử X bằng 58 hạt, trong đó số hạt mang điện tích âm ít hơn số hạt không mang điện là 1 hạt. Tổng số hạt mang điện của X là:
A. 19. B. 38. C. 20. D. 39.
Câu 14: Cho 2,88 gam kim loại M nhóm IIA tác dụng hết với H2SO4 loãng, dư thoát ra 2,688 lít khí H2 (đktc). Kim loại M là
A. Ca B. Be C. Mg D. Ba
Câu 15: Khối lượng nguyên tử trung bình của clo (Cl) là 35,5. Trong tự nhiên clo có hai đồng vị trong đó một đồng vị là 35Cl chiếm 75%. Tìm số khối của đồng vị còn lại.
A. 71 B. 37 C. 36 D. 38
Câu 16: Nhỏ từ từ 3V1 ml dung dịch Ba(OH)2 (dd X) vào V1 ml dung dịch Al2(SO4)3 (dd Y) thì phản ứng vừa đủ và ta thu được kết tủa lớn nhất là m gam. Nếu trộn V2 ml dung dịch X ở trên vào V1 ml dung dịch Y thì kết tủa thu được có khối lượng bằng 0,9m gam. So sánh tỉ lệ V2 / V1 thấy
A. V2 / V1 = 2,5 hoặc V2 / V1 = 3,25 B. V2 / V1 = 2,5 hoặc V2 / V1 = 3,55
C. V2 / V1 = 2,7 hoặc V2 / V1 = 3,55 D. V2 / V1 = 2,7 hoặc V2 / V1 = 3,75
Phần II: Tự luận (6,0 điểm)
Câu 1 ( 2 điểm): Viết cấu hình electron nguyên tử của các nguyên tố sau: 12Mg, 24Cr. Và cho biết tính chất (kim loại, phi kim hay khí hiếm) của các nguyên tố đó.
Câu 2 ( 2 điểm): So sánh tính phi kim của 8A và 16B.
Câu 3 (2 điểm): R có cấu hình e lớp ngoài cùng là ns2np3 (n là số thứ tự của chu kì). Trong hợp chất khí với hiđro của R có 17,64% hiđro về khối lượng.
Xác định nguyên tố R.

-----------------------------------------------------------------------------------------------------------------------
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1
Năm học 2021 - 2022
Bài thi môn: Hóa Học lớp 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 4)
Cho biết số hiệu và nguyên tử khối (đvC) của các nguyên tố: 1H=1; 2He=4; 3Li = 7, 4Be=9; 5B=11; 6C=12; 7N=14; 8O=16; 9F=19; 10Ne=20; 11Na=23; 12Mg=24; 13Al=27; 14Si=28; 15P=31; 16S=32; 17Cl=35,5; 18Ar=40; 19K=39; 20Ca=40;
Câu 1. Trong nguyên tử, lớp electron thứ 3 có kí hiệu là
A. lớp L. B. lớp N. C. lớp K. D. lớp M
Câu 2. Cấu hình electron bền của nguyên tử nguyên tố 24Cr là
A. 1s22s22p63s23p64s13d5. B. 1s22s22p63s23p63d44s2.
C. 1s22s22p63s23p63d54s1. D. 1s22s22p63s23p64s23d4.
Câu 3. Số proton và số nơtron trong hạt nhân nguyên tử 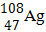 lần lượt là
lần lượt là
A. 47; 61. B. 61; 47. C. 108; 47. D. 47; 108.
Câu 4. Các đồng vị của cùng một nguyên tố hoá học thì chúng có
A. cùng số nơtron nhưng khác số khối. B. cùng số hạt nơtron.
C. cùng số hạt proton. D. cùng số khối.
Câu 5. Trong bảng tuần hoàn các nguyên tố hoá học, có bao nhiêu chu kì nhỏ ?
A. 4. B. 3. C. 2. D. 1.
Câu 6. Một nguyên tử có eletron ở phân lớp ngoài cùng (có năng lượng cao nhất) là 4s1. Điện tích hạt nhân nguyên tử của nguyên tố đó là
A. 20. B. 19. C. 18+. D. 19+.
Câu 7. Một nguyên tử X có số hiệu nguyên tử Z = 19. Số lớp electron trong nguyên tử X là
A. 5. B. 6. C. 3. D. 4.
Câu 8. Nguyên tử X có 13 proton và 14 nơtron. Số electron trong nguyên tử X là
A. 13. B. 14. C. 27. D. 26.
Câu 9. Cho các hình vẽ sau, mỗi hình cầu là 1 trong các nguyên tử 9F, 17Cl, 16 S, 15 P tương ứng theo thứ tự là.

A. F, Cl, P, S. B. Cl, S, P, F. C. F, P, S, Cl. D. P, S, Cl, F.
Câu 10. Cho các nguyên tố X1, X2, X3, X4 lần lượt có cấu hình electron như sau:
X1: 1s22s22p63s2; X2: 1s22s22p63s23p64s1; X3:1s22s22p63s23p64s2; X4: 1s22s22p63s23p5;
Các nguyên tố nào sau đây thuộc cùng một chu kì 4:
A. X1, X2. B. X2, X3. C. X1, X4. D. X2, X4.
Câu 11. Nguyên tử X có cấu hình electron là:1s22s22p63s23p4. Ion mà X có thể tạo thành để trở về cấu hình electron bền giống khí hiếm gần nó là:
A. X+. B. X2-. C. X2+. D. X-.
Câu 12. Nguyên tố Y có Z=28. Vị trí của Y trong bảng hệ thống tuần hoàn là:
A. Chu kì 4, nhóm IIB. B. Chu kì 4, nhóm VIIA.
C. Chu kì 4, nhóm VIIB. D. Chu kì 4, nhóm VIIIB.
Câu 13. Trong nguyên tử Y có tổng số proton, nơtron và electron là 24. Trong hạt nhân nguyên tử, số hạt mang điện bằng số hạt không mang điện. Hãy cho biết kí hiệu hóa học của nguyên tử nguyên tố Y ?
A.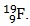 B.
B. 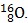 C.
C. 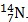 D.
D. 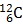
Câu 14. Nguyên tố cacbon có 2 đồng vị 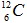 chiếm 98,8% và
chiếm 98,8% và 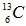 chiếm 1,2%. Nguyên tử khối trung bình của cacbon là
chiếm 1,2%. Nguyên tử khối trung bình của cacbon là
A. 12,055 B. 12,011 C. 12,5 D. 12,012
Câu 15. Ion X- có cấu hình electron: 1s22s22p63s23p6. Vị trí của X trong bảng hệ thống tuần hoàn là:
A. Chu kì 3, nhóm VIIIA. B. Chu kì 3, nhóm VIIA.
C. Chu kì 3, nhóm VIA. D. Chu kì 4, nhóm IA.
Câu 16. Cho 2 nguyên tố X (Z=11); Y (Z=12). Nhận định nào là đúng
1.Tính kim loại của X>Y(1).
2.Bán kính nguyên tử của X>Y(2).
3. Độ âm điện của X<Y(3).
A. (1),(2) đều đúng. B. (1),(3) đều đúng.
C. (2),(3) đều đúng. D. Tất cả (1),(2),(3) đều đúng.
Câu 17. Ion M 3+ có cấu hình e là 1s22s22p6.Cấu hình electron của nguyên tử M là
A. 1s22s22p63s2. B. 1s22s22p6 3s23p1.
C. 1s22s22p5. D. 1s22s22p6..
Câu 18.Một nguyên tử X có tổng số e ở các phân lớp p là 11. Hãy cho biết X thuộc về nguyên tố hoá học nào sau đây?
A. Clo. B. Nitơ. C. Nhôm. D. Flo.
Câu 19. Nguyên tử X có tổng số hạt là 28, trong đó số hạt không mang điện tích chiếm 35,71% tổng số hạt. Nguyên tử X là
A. Oxi. B. Flo. C. Nitơ. D. Clo.
Câu 20. Cho các phát biểu sau:
(1). Tất cả các hạt nhân nguyên tử đều được cấu tạo từ các hạt proton và nơtron.
(2). Khối lượng nguyên tử tập trung phần lớn ở hạt nhân.
(3). Trong nguyên tử số electron bằng số proton.
(4). Đồng vị là những nguyên tử có cùng số khối.
(5). Hầu hết nguyên tử được cấu tạo bởi 3 loại hạt cơ bản.
Số phát biểu đúng là
A. 5. B. 4. C. 2. D. 3.
Câu 21. Cho 2,4 gam kim loại Mg vào dung dịch HCl dư thấy giải phóng V lít khí H2(đktc).Giá trị của V và là
A. V= 4,48 lít. B. V= 3,36 lít. C. V= 2,24 lít. D. V= 0,224 lít.
Câu 22. Hợp chất khí với hiđro của nguyên tố R là RH2. Trong oxit cao nhất của R có 60,0% oxi về khối lượng. Nguyên tố R là
A. Si. B. P. C. S. D. Cl.
Câu 23. Cho 2,3 gam kim loại N thuộc nhóm IA vào H2O thấy giải phóng 1,12 lít khí H2(đktc).Kim loại N là
A. Na. B. Rb C. K. D. Li.
Câu 24. Hai kim loại X và Y thuộc 1 nhóm A và 2 chu kì liên tiếp nhau trong BTH có tổng số proton trong hai hạt nhân nguyên tử là 30. X và Y lần lượt là
A. K và Rb B. Na và Mg C. Na và K D. Li và Na
Câu 25. Clo có 2 loại đồng vị là 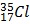 và
và 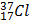 . Biết
. Biết 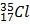 chiếm 75%. Nguyên tử khối trung bình của Clo là
chiếm 75%. Nguyên tử khối trung bình của Clo là
A. 36. B. 35. C. 37. D. 35,5.
-------------------------------------------------------------
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1
Năm học 2021 - 2022
Bài thi môn: Hóa Học lớp 10
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 5)
Câu 1: Agon có ba đồng vị có số khối lần lượt là 36; 38 và A. Thành phần phần trăm số nguyên tử của các đồng vị tương ứng bằng: 0,34%; 0,06%; 99,60%. Nguyên tử khối trung bình của agon là 39,98. Giá trị của A là
A. 40. B. 37. C. 35. D. 41.Câu 1: Agon có ba đồng vị có số khối lần lượt là 36; 38 và A. Thành phần phần trăm số nguyên tử của các đồng vị tương ứng bằng: 0,34%; 0,06%; 99,60%. Nguyên tử khối trung bình của agon là 39,98. Giá trị của A là
Câu 2: Các phân lớp electron có trong lớp M là
A. 2s, 2p.
B. 3s, 3p, 3d.
C. 4s, 4p, 4d, 4f.
D. 1s.
Câu 3: Nguyên tố X có kí hiệu nguyên tử là . Kết luận nào sau đây về cấu tạo nguyên tử là đúng?
A. X có 9 proton, số khối hạt nhân nguyên tử X là 10.
B. X có 10 proton, số khối hạt nhân nguyên tử X là 19.
C. X có 9 proton, số khối hạt nhân nguyên tử X là 19.
D. X có 10 proton, 19 nơtron.
Câu 4: Một nguyên tố A có kí hiệu nguyên tử là . Nguyên tố này tạo được ion có dạng A2+. Số proton, nơtron và electron trong ion này lần lượt là
A. 58, 79, 56. B. 56, 81, 54.
C. 58, 77, 56. D. 56, 79, 54.
Câu 5: Một nguyên tố X có 4 đồng vị bền với hàm lượng % số nguyên tử mỗi đồng vị lần lượt như sau:
|
Đồng vị |
54X |
56X |
57X |
58X |
|
Hàm lượng (%) |
5,78 |
91,72 |
2,22 |
0,28 |
Nguyên tử khối trung bình của X là
A. 56,25. B. 55,91. C. 56,00. D. 55,57.
Câu 6: Hợp chất MXa có tổng số proton là 58. Trong hạt nhân M, số nơtron nhiều hơn số proton là 4. Trong hạt nhân X, số proton bằng số nơtron. Phân tử khối của MXa là
A. 116. B. 120. C. 56. D. 128.
Câu 7: Trong số các nguyên tử và ion sau đây: ;; ; ; , có bao nhiêu hạt có 8 electron ở lớp ngoài cùng?
A. 2. B. 3. C. 4. D. 5.
Câu 8: Nguyên tử của nguyên tố có kí hiệu . Cho các phát biểu sau về Z:
1. Z có 20 nơtron.
2. Z có 20 proton.
3. Z có 2 electron hóa trị.
4. Z có 4 lớp electron.
Trong các phát biểu trên, số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
Câu 9: Nguyên tử của nguyên tố X có 21 electron. Khi mất đi toàn bộ electron hóa trị, điện tích của ion này là
A. 1+. B. 2+. C. 3+. D. 4+.
Câu 10: Nguyên tử của nguyên tố Y có 8 electron. Nếu Y nhận thêm electron để lớp ngoài cùng bão hòa thì điện tích ion thu được là
A. 1-. B. 2-. C. 3-. D. 4-.
Câu 11: A và B là hai đồng vị của nguyên tố X. Tổng số hạt cơ bản trong A và B là 50, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 14. Số hiệu nguyên tử X là
A. 8. B. 10. C. 16. D. 32.
Câu 12. Bảng tuần hoàn có
A. 4 chu kì nhỏ; 4 chu kì lớn. B. 3 chu kì nhỏ; 4 chu kì lớn.
C. 4 chu kì nhỏ; 3 chu kì lớn. D. 4 chu kì nhỏ; 4 chu kì lớn.
Câu 13. Nguyên tố X có Z = 18 thuộc loại nguyên tố nào sau đây?
A. Kim loại. B. Phi kim. C. Khí hiếm. D. á kim.
Câu 14. Chu kì 3 có bao nhiêu nguyên tố?
A. 18. B. 8. C. 2. D. 32.
Câu 15. Phát biểu nào sau đây là sai?
A. Nguyên tử kim loại thường có 1, 2 hoặc 3 electron ở lớp ngoài cùng.
B. Các nhóm A bao gồm các nguyên tố s và nguyên tố p.
C. Trong một chu kì, bán kính nguyên tử kim loại nhỏ hơn bán kính nguyên tử phi kim.
D. Các kim loại thường có ánh kim do các electron tự do phản xạ ánh sáng nhìn thấy được
Câu 16. Nguyên tử X có cấu hình electron của phân lớp có năng lượng cao nhất là 3p4. Hãy chỉ ra câu sai khi nói về nguyên tử X?
A. Trong bảng tuần hoàn, X nằm ở nhóm IVA.
B. Lớp ngoài cùng của nguyên tử X có 6 electron.
C. Trong bảng tuần hoàn, X nằm ở chu kì 3.
D. Hạt nhân nguyên tử X có 16 proton.
Câu 17. Trong các mệnh đề sau, mệnh đề nào sai?
A. Khối các nguyên tố d gồm các nguyên tố thuộc các nhóm B.
B. Khối nguyên tố f gồm các nguyên tố xếp hai hàng cuối bảng.
C. Bảng tuần hoàn gồm 8 nhóm A và 8 nhóm B.
D. Bảng tuần hoàn gồm 16 cột.
Câu 18. Nguyên tố X có số hiệu nguyên tử là 23 có vị trí trong bảng tuần hoàn là
A. Chu kỳ 4, nhóm VB. B. Chu kỳ 3, nhóm IIIA.
C. Chu kỳ 3, nhóm III B. D. Chu kỳ 4, nhóm IIIA.
Câu 19. Nguyên tố X có tổng số proton, nơtron, electron là 13. Vậy X thuộc
A. Chu kì 2, nhóm IIIA. B. Chu kì 3, nhóm IIA.
C. Chu kì 2, nhóm IIA. D. Chu kì 3, nhóm IVA.
Câu 20. Hai nguyên tố X và Y kế tiếp nhau trong cùng một chu kì của bảng tuần hoàn có tổng số điện tích hạt nhân là 39. X và Y là (biết X đứng trước Y)
A. 24Cr và 15P. B. 8O và 17Cl.
C. 12Mg và 13Al. D. 19K và 20Ca.
Câu 21. Nhận định nào sau đây không đúng?
A. Chu kỳ gồm các nguyên tử có số lớp electron bằng nhau.
B. Trong bảng tuần hoàn các nguyên tố được xếp theo chiều tăng của khối lượng nguyên tử.
C. Các nguyên tử có số lớp electron bằng nhau xếp cùng một hàng.
D. Các nguyên tử có số electron hoá trị bằng nhau xếp cùng một cột.
Câu 22. Công thức chung của các oxit kim loại nhóm IA là
A. R2O. B. RO2 . C. RO. D. R2O3
Câu 23. Phần trăm khối lượng của nguyên tố R trong hợp chất khí với hiđro (R có số oxi hóa thấp nhất) và trong oxit cao nhất tương ứng là a% và b%, với a : b = 15 : 8, biết R có cấu hình electron ở lớp ngoài cùng là ns2np2. Giá trị a là
A. 75,00%. B. 87,50%. C. 82,35%. D. 94,12%.
Câu 24. Cho 1,2 gam kim loại M khi tan hết trong dung dịch HCl giải phóng 1,12 lít khí H2ở đktc. Kim loại M là
A. C (M = 12). B. Mg (M = 24).
C. Ca (M = 40). D. Na (M = 23).
Câu 25. Anion X2- có cấu hình electron: 1s22s22p63s23p6. Nguyên tử nguyên tố X thuộc
A. Chu kỳ 3 nhóm VIA. B. Chu kỳ 3 nhóm VIIIA.
C. Chu kỳ 4 nhóm IIA. D. Chu kỳ 4 nhóm VIA.
Câu 26. Nguyên tử X có phân lớp electron ngoài cùng là 3p4. Hãy xác định câu sai trong các câu sau khi nói về nguyên tử X.
A. Lớp ngoài cùng của X có 6 electron.
B. Hạt nhân nguyên tử X có 16 electron .
C. Trong bảng tuần hoàn X nằm ở chu kì 3.
D. X nằm ở nhóm VIA.
Câu 27. Độ âm điện là
A. Khả năng nhường electron của nguyên tử cho nguyên tử khác.
B. Khả năng tham gia phản ứng mạnh hay yếu.
C. Khả năng nhường proton của nguyên tử này cho nguyên tử khác.
D. Khả năng hút electron của nguyên tử khi hình thành liên kết hóa học.
Câu 28. Biết nguyên tố X thuộc chu kì 4 nhóm IIIA của bảng tuần hoàn. Cấu hình electron nguyên tử của X là
A. 1s22s22p63s23p63d104s24p3. B. 1s22s22p63s23p64s24p63d5.
C. 1s22s22p63s23p63d104s24p1. D. 1s22s22p63s23p4.
Câu 29. Nguyên tố R thuộc chu kì 3, nhóm VIIA trong bảng tuần hoàn. Công thức oxit cao nhất của R là
A. RO3. B. R2O7. C. R2O3. D. R2O.
Câu 30. R thuộc chu kì 2 nhóm VA của bảng tuần hoàn. Cho biết cấu hình electron của R có bao nhiêu electron s ?
A. 2. B. 4. C.3. D. 6.
-----------------------------------------------------------------------------------------------------------------------
Mời quý thầy cô và học sinh xem bản đầy đủ ở mục tải về


