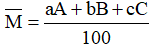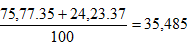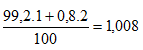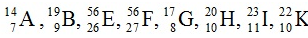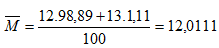Cách tính phần trăm đồng vị, tính nguyên tử khối trung bình hay, chi tiết
Cách tính phần trăm đồng vị, tính nguyên tử khối trung bình hay, chi tiết Hóa học lớp 10 với đầy đủ lý thuyết, phương pháp giải và bài tập có lời giải cho tiết sẽ giúp học sinh nắm được Cách tính phần trăm đồng vị, tính nguyên tử khối trung bình hay, chi tiết
Cách tính phần trăm đồng vị, tính nguyên tử khối trung bình hay, chi tiết
-
A. Phương pháp & Ví dụ
Lý thuyết và Phương pháp giải
- Áp dụng công thức tính nguyên tử khối trung bình:
Với: a, b, c là số nguyên tử (hoặc % số nguyên tử) của mỗi đồng vị.
A, B, C là nguyên tử khối (hay số khối) của mỗi đồng vị.
- Xác định phần trăm các đồng vị
Gọi % của đồng vị 1 là x %
⇒ % của đồng vị 2 là (100 – x).
- Lập phương trình tính nguyên tử khối trung bình ⇒ giải được x.
Cách 2: phương pháp giải nhanh sử dụng đường chéo để làm bài

-
Ví dụ minh họa
-
Ví dụ 1: Trong tự nhiên, X có hai đồng vị 1735X và 1737X, chiếm lần lượt 75,77% và 24,23% số nguyên tử X. Y có hai đông vị à 11Y và 12Y, chiếm lần lượt 99,2% và 0,8% số nguyên tử Y.
a) Trong tự nhiên có bao nhiêu loại phân tử XY?
A. 2 B. 4 C. 5 D. 6
b) Phân tử khối trung bình của XY là
A. 36,0. B. 36,5. C. 37,5. D. 37,0.
Hướng dẫn:
a) Các loại phân tử XY là : 35X – 1Y, 35X – 2Y, 37X – 1Y, 37X – 2Y
b) Nguyên tử khối trung bình của X :
Nguyên tử khối trung bình Y là:
Phân tử khối trung bình của XY: 35,485 + 1,008 =36,493 ≈ 36,5.
Ví dụ 2: Trong dãy kí hiệu các nguyên tử sau: .
Các kí hiệu nào cùng chỉ cùng 1 nguyên tố hoá học?
A. A, G và B B. H và K C. H, I và K D. E và F
Hướng dẫn:
H và K cùng 1 nguyên tố hóa học do có cùng số p là 10
⇒ Chọn B.
Ví dụ 3: Nguyên tố Cacbon có 2 đồng vị bền: 612C chiếm 98,89% và 613C chiếm 1,11%. Nguyên tử khối trung bình của C là bao nhiêu?
Hướng dẫn:
Vậy NTK trung bình của C là 12,0111
Ví dụ 4: Đồng có 2 đồng vị là 2963Cu và 2965Cu. Nguyên tử khối trung bình của đồng là 63,54. Tính thành phần phần trăm số nguyên tử của mỗi đồng vị.
Hướng dẫn:
Đặt thành phần phần trăm của 2963Cu và 2965Cu lần lượt là x và 1-x (%)
M− = 63.x +65.(1-x) = 63.54
Giải PT ⇒ x= 0,73 (73%)
% 2963Cu = 73%; và % 2965Cu = 27%
-
-
Ví dụ 5: Đồng vị là những nguyên tử của cùng một nguyên tố, có số proton bằng nhau nhưng khác nhau về:
A. số electron B. số notron C. số proton D. số obitan
Hướng dẫn:
⇒ Chọn B.
Nhắc lại: Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số proton nhưng khác nhau về số notron, do đó số khối A khác nhau.
B. Bài tập trắc nghiệm
-
Câu 1. Nguyên tố cacbon có hai đồng vị bền: 12Cchiếm 98,89% và 13C chiếm 1,11%. Nguyên tử khối trung bình của nguyên tố cacbon là
A. 12,5245 B. 12,0111 C. 12,0219 D. 12,0525
Câu 2. Trong dãy kí hiệu các nguyên tử sau, dãy nào chỉ cùng một nguyên tố hóa học:
A. 6A14 ; 7B15 B. 8C16; 8D17; 8E18 C. 26G56; 27F56 D. 10H20 ; 11I22
Câu 3. Cho ba nguyên tử có kí hiệu là
Phát biểu nào sau đây là sai ?
A. Số hạt electron của các nguyên tử lần lượt là: 12, 13, 14.
B. Đây là 3 đồng vị.
C. Ba nguyên tử trên đều thuộc nguyên tố Mg.
D. Hạt nhân của mỗi nguyên tử đều có 12 proton.
Câu 4. Nguyên tố clo có hai đồng vị bền 1735Cl chiếm 75,77% và 1737Cl chiếm 24,23%. Tính nguyên tử khối trung của clo?
A. 35 B. 35,5 C. 36 D. 37
Câu 5. Có 3 nguyên tử:
Những nguyên tử nào là đồng vị của một nguyên tố?
A. X, Y B. Y, Z C. X, Z D. X, Y, Z
Câu 6. Nguyên tử khối trung bình của đồng là 63,54. Trong tự nhiên, đồng có hai đồng vị
Tính tỉ lệ phần trăm số nguyên tử của đồng vị 2963Cu tồn tại trong tự nhiên
A. 28% B. 73% C 42% D. 37%
Câu 7. Trong tự nhiên có hai đồng vị bền: 1737Cl chiếm 24,23% tổng số nguyên tử, còn lại là 1735Cl. Thành phần % theo khối lượng của 1737Cl trong HClO4 là:
A. 8,92% B. 8,43% C. 8,56% D. 8,79%
-
-
Câu 8. Nguyên tố hóa học bao gồm các nguyên tử:
A. Có cùng số khối A. B. Có cùng số proton.
C. Có cùng số nơtron. D. Có cùng số proton và số nơtron.
-
Câu 9. Trong tự nhiên Oxi có 3 đồng vị 16O(x1%) , 17O(x2%) , 18O(4%), nguyên tử khối trung bình của Oxi là 16,14. Phần trăm đồng vị 16O và 17O lần lượt là
A. 35% & 61% B. 90% & 6% C. 80% & 16% D. 25% & 71%
Câu 10. Một nguyên tố X gồm hai đồng vị là X1 và X2. Đồng vị X1 có tổng số hạt là 18. Đồng vị X2 có tổng số hạt là 20. Biết rằng % các đồng vị trong X bằng nhau và các loại hạt trong X1 cũng bằng nhau. Xác định nguyên tử khối trung bình của X?
A. 13 B. 19 C. 12 D. 16