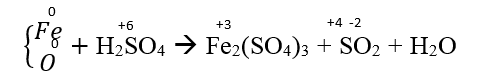Trắc nghiệm Hóa học 10 Bài 34 có đáp án năm 2021 - 2022
Bộ câu hỏi trắc nghiệm Hóa học lớp 10 có đáp án, chọn lọc năm 2021 – 2022 mới nhất gồm các câu hỏi trắc nghiệm đầy đủ các mức độ nhận biết, thông hiểu, vận dụng, vận dung cao. Hy vọng với tài liệu trắc nghiệm Hóa học lớp 10 sẽ giúp học sinh củng cố kiến thức, ôn tập và đạt điểm cao trong các bài thi trắc nghiệm môn Hóa học 10
Trắc nghiệm Hóa học 10 Bài 34: Luyện tập: Oxi và lưu huỳnh
Bài 1: Nung m gam bột sắt trong oxi, thu được 12 gam hỗn hợp chất rắn X. Hòa tan hết hợp X trong dung dịch H2SO4 đặc, nóng (dư), thu được 3,36 lít khí SO2 (là sản phẩm khử duy nhất, ở đktc). Giá trị của m là
A. 10,08 B. 16,80 C. 5,60 D. 8,40
Đáp án: A
nSO2 = 3,36/22,4 = 0,15 mol
⇒ mhh = mFe + mO
Bảo toàn electron: 3nFe = 2nO + 2nSO2
⇒ 56nFe + 16nO = 12; 3nFe - 2nO =2.0,15
⇒ nFe = 0,18; nO = 0,12
⇒ m = 0,18.56 = 10,08 (gam)
Bài 2: Cho các chất: HI, H2S, C, CaCO3, Fe3O4, FeO, Al và Fe2O3. Trong các chất đã cho, số chất có thể bị oxi hóa bởi dung dịch axit H2SO4 đăc, nóng là
A. 5 B. 4 C. 6 D. 7
Đáp án: C
Bài 3: Oxi hóa hoàn toàn 10,8 gam kim loại X trong khí O2 (dư), thu được 20,4 gam oxit kim loại. X là kim loại
A. Al B. Fe C. Mg D. Ca
Đáp án: A
Bảo toàn khối lượng: nO2 = (20,4-10,8)/32 = 0,3 mol
Bảo toàn electron: 10,8/M.n = 4.0,3 ⇒ M=9n ⇒ n=3; M=27(Al).
Bài 4: Đun nóng 11,2 gam bột sắt với 9,6 gam bột lưu huỳnh trong điều kiện không có không khí, thu được hỗn hợp rắn X. Hòa tan hoàn toàn X vào dung dịch HCl dư, thu được khí Y. Hấp thụ toàn bộ Y vào lượng dư dung dịch Pb(NO3)2, thu được m gam kết tủa. Giá trị của m là
A. 13,9 B. 47,8 C. 71,7 D. 51,0
Đáp án: B
nFe = 11,2/56 = 0,2 mol ; nS = 9,6/32 = 0,3(mol) ⇒ nFeS = 0,2 mol
⇒ nPbS = nH2S = nFeS = 0,2 mol ⇒ m = 0,2.239 = 47,8 (gam)
Bài 5: Đốt cháy hoàn toàn 2,24 lít H2S (đktc). Hấp thụ toàn bộ sản phẩm cháy vào 100 gam dung dịch NaOH 12% thu được dung dịch X. Nồng độ phần trăm của muối trong X là
A. 5,82% B. 11,84% C. 11,65% D. 9,61%
Đáp án: C

Bài 6: Để phản ứng vừa đủ với 100 ml dung dịch BaCl2 2M cần 500 ml dung dịch Na2SO4 a (mol/l). Giá trị của a là
A. 0,1 B. 0,4 C. 0,5 D. 0,2
Đáp án: B
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
nBaCl2 = nNa2SO4 ⇒ 0,5a =2.0,1 ⇒ a = 0,4 (mol/l)
Bài 7: Dẫn V lít khí SO2 (đktc) vào lượng dư dung dịch Br2, thu được dung dịch X. Cho dung dịch BaCl2 dư vào X, thu được 23,3 gam kết tủa. Giá trị của V là
A. 3,36 B. 1,12 C. 4,48 D. 2,24
Đáp án: D
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
BaCl2 + Na2SO4 → BaSO4 + 2NaCl
nSO2 = nH2SO4 = nBaSO4 = 23,3/233 = 0,1 mol
⇒ V = 0,1.22,4 = 2,24 (lít)
Bài 8: Hòa tan hoàn toàn 15,2 gam hỗn hợp Cu và Fe vào lượng dư dung dịch H2SO4 đăc, nong, thu được 6,72 lít khí SO2 (đktc). Thành phần phần trăm khối lượng của Fe trong hỗn hợp đầu là
A. 36,84% B. 73,68% C. 55,26% D. 18,42%
Đáp án: A
nSO2 = 6,72/22,4 = 0,3 mol
⇒ mhh = mCu + mFe
Bảo toàn electron: 2nCu + 3nFe = 2nSO2
⇒ 64nCu + 56nFe = 15,2; 2nCu + 3nFe = 2.0,3
⇒ nCu = 0,15; nFe = 0,1 ⇒ %mFe = 0,01.56/15,2.100% = 36,84%
Bài 9: Hòa tan hết 1,69 gam oleum có công thức H2SO4.3SO3 vào nước dư. Trung hòa dung dịch thu được cần V ml dung dịch KOH 1M. Giá trị của V là
A. 20 B. 40 C. 30 D. 10
Đáp án: B
nH2SO4.3SO3 = 1,69/338 = 0,005 mol
H2SO4.3SO3 + 3H2O → 4H2SO4
H2SO4 + 2KOH → K2SO4 + 2H2O
⇒ V = 0,04 lít = 40 ml
Bài 10: Dung dịch H2SO4 loãng phản ứng được với tất cả các chất trong dãy nào trõng dãy chất nào sau đây?
A. Al2O3, Ba(OH)2, Ag
B. CuO, NaCl, CuS
C. FeCl3, MgO, Cu
D. BaCl2, Na2CO3, FeS
Đáp án: D
Bài 11: Trong công nghiệp, người ta điều chế oxi bằng cách
A. nhiệt phân KMnO4
B. nhiệt phân Cu(NO3)2
C. nhiệt phân KClO3 có xúc tác MnO2
D. chưng cất phân đoạn không khí lỏng
Đáp án: D
Bài 12: Cho phương trình hóa học: aS + bH2SO4 (đặc) → cSO2 ↑ + dH2O
Tỉ lệ a:b là
A. 1:1 B. 2:3 C. 1:3 D. 1:2
Đáp án: D
Bài 13: Phương trình hóa học nào sau đây không đúng?
A. 2CO + O2 to → 2CO2
B. Fe + S to → FeS
C. S + F2 to → SF2
D. 3Fe + 2O2 to → Fe3O4 .
Bài 14: Dẫn mẫu khí thải của một nhà máy qua dung dịch Pb(NO3)2 dư thì thấy xuất hiện kết tủa đen. Hiện tượng đó chứng tỏ trong khí thải nhà máy có khí nào sau đây?
A. H2S B. NH3 C. SO2 D. CO2
Đáp án: A
Bài 15: Để phân biệt SO2 và CO2 chỉ cần dùng thuốc thử là
A. dung dịch Ba(OH)2
B. CaO
C. dung dịch NaOH
D. nước brom
Đáp án: D
Bài 16: Để loại bỏ các khí HCl, CO2 và SO2 có lẫn trong khí N2, người ta sử dụng lượng dư dung dịch
A. NaCl B. CuCl2 C. Ca(OH)2 D. H2SO4
Đáp án: C