Trắc nghiệm Hóa học 10 Bài 6 có đáp án năm 2021 - 2022
Bộ câu hỏi trắc nghiệm Hóa học lớp 10 có đáp án, chọn lọc năm 2021 – 2022 mới nhất gồm các câu hỏi trắc nghiệm đầy đủ các mức độ nhận biết, thông hiểu, vận dụng, vận dung cao. Hy vọng với tài liệu trắc nghiệm Hóa học lớp 10 sẽ giúp học sinh củng cố kiến thức, ôn tập và đạt điểm cao trong các bài thi trắc nghiệm môn Hóa học 10
Trắc nghiệm Hóa học 10 Bài 6: Luyện tập: Cấu tạo vỏ nguyên tử
Bài 1: Tổng số các hạt proton, nơtron và electron trong nguyên tử của một nguyên tố là 40. Biết số hạt nơtron lớn hơn số hạt proton là 1. Cho biết nguyên tố trên thuộc loại nguyên tố nào?
A. Nguyên tố s.
. Nguyên tố p.
C. Nguyên tố d.
D. Nguyên tố f.
Đáp án:
Giả sử số hiệu nguyên tử, số nơtron của nguyên tố trên lần lượt là Z, N
Ta có hpt:
Cấu hình electron của nguyên tố là: 1s22s22p63s23p1
Nhận thấy electron cuối cùng điền vào phân lớp p → nguyên tố trên thuộc loại nguyên tố p.
Bài 2: Biết rằng tổng số hạt (proton, nowtron, electron) của một nguyên tử X là 20. Tổng số phân lớp electron trong nguyên tử của nguyên tố X là
A. 5
B. 4
C. 3
D. 2
Đáp án: C
Theo đề: 2p + n = 20
Cấu hình electron: 1s22s22p2 ⇒ Có 3 phân lớp electron.
Bài 3: A và B là hai nguyên tố đều có cùng số electron ở lớp ngoài cùng và là nguyên tố s hoặc p. biết rằng tổng số proton trong A và B là 32, A có ít hơn B một lớp electron. Số electron lớp ngoài cùng của A và B là
A. 1
B. 2
C. 3
D. 4
Đáp án: D
Nếu A và B cùng là nguyên tố s hoặc p.
Nếu A ít hơn B 1 lớp electron thì A có thể ít hơn B là 2 hoặc 8 hoặc 18 electron.
Nếu eB - eA = 2 và eB + eA = 32.
⇒ eB = 17 và eA = 15 ( loại vì 2 nguyên tố này có cùng lớp electron).
Nếu eB - eA = 8 và eB + eA = 32 ⇒ eB = 20 và eA = 12 (chọn).
Nếu eB - eA = 18 và eB + eA = 32 ⇒ eB = 25 và eA = 7(loại vì 2 nguyên tố này khác nhau 2 lớp electron).
Vậy A và B có 2 electron ở lớp ngoài cùng.
Bài 4: Hợp chất H có công thức MX2 trong đó M chiếm 140/3% về khối lượng, X là phi kim ở chu kỳ 3, trong hạt nhân của M có số proton ít hơn số nơtron là 4; trong hạt nhân của X có số proton bằng số nơtron. Tổng số proton trong 1 phân tử A là 58. Cấu hình electron ngoài cùng của M là.
A. 3d104s1.
B. 3s23p4.
C. 3d64s2.
D. 2s22p4.
Đáp án: C
Tổng số proton trong MX2 là 58 hạt → ZM + 2.ZX = 58
Trong hạt nhân M có số notron nhiều hơn số hạt proton là 4 hạt → -ZM + NM = 4
Trong hạt nhân X, số notron bằng số proton → ZX = NX
MA = ZM + NM + 2.ZX + 2.NX = (ZM + 2.ZX ) + NM + 2NX= 58 + NM + 58 - ZM = 116 + NM- ZM
M chiếm 46,67% về khối lượng → ZM + NM = 7.(116 + NM - ZM)/15 → 22ZM + 8NM = 812
Ta có hệ 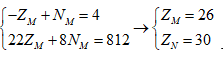
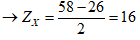
Cấu hình electron của M là [Ar]3d64s2.
Bài 5: Nguyên tử M có cấu hình electron ngoài cùng là 3d74s2. Số hiệu nguyên tử của M
A. 24
B. 25
C. 27
D. 29
Đáp án: C
Cấu hình electron của nguyên tử M là 1s22s22p63s23p63d74s2
Số hiệu nguyên tử của M là 27.

Bài 6: Nguyên tử 27X có cấu hình electron là 1s22s22p63s23p1. Hạt nhân nguyên tử X có
A. 13 proton và 14 nơtron.
B. 13 proton và 14 electron.
C. 14 proton và 13 nơtron.
D. 14 proton và 14 electron.
Đáp án: A
Bài 7: X không phải là khí hiếm, nguyên tử nguyên tố X có phân lớp electron ngoài cùng là 3p. Nguyên tử nguyên tố Y có phân lớp electron ngoài cùng là 3s. Tổng số electron ở hai phân lớp ngoài cùng của X và Y là 7. Xác định số hiệu nguyên tử của X và Y
A. X (Z = 18); Y (Z = 10).
B. X (Z = 17); Y (Z = 11).
C. X (Z = 17); Y (Z = 12).
D. X (Z = 15); Y (Z = 13).
Đáp án: C
• TH1: Y có phân lớp ngoài cùng là 3s1 → Y có cấu hình electron là 1s22s22p63s1
→ Y có 11e → Y có Z = 11.
X có số electron ở phân lớp ngoài cùng = 7 - 1 = 6 → X có phân lớp ngoài cùng là 3p6 → X là khí hiếm → loại.
• TH2: Y có phân lớp ngoài cùng là 3s2 → tương tự ta có Y có Z = 12.
Khi đó, X có lớp ngoài cùng là 3p5 → X có cấu hình electron là 1s22s22p63s23p5
→ X có 17 e → Z = 17.
Bài 8: Nguyên tử của nguyên tố T có e ở mức năng lượng cao nhất ở lớp e thứ 3, trong nguyên tử của Y số e nằm ở phân lớp s bằng 2/3 số e nằm ở phân lớp p. Nguyên tố T là
A. S
B. P
C. Si
D. Cl
Đáp án: B
Nguyên tử của nguyên tố T có e ở mức năng lượng cao nhất ở lớp e thứ 3 → số electron ở phân lớp s gồm 1s2, 2s2, 3s2 → 6 electron ở phân lớp s
→ Số electron ở phân lớp p là 9
Cấu hình của Y là 1s22s22p63s23p3 (Z = 15) → T là P
Bài 9: Nguyên tố X thuộc loại nguyên tố d, nguyên tử X có 5 electron hoá trị và lớp electron ngoài cùng thuộc lớp N.Cấu hình electron của X là:
A. 1s22s22p63s23p63d34s2
B. 1s22s22p63s23p64s23d3
C. 1s22s22p63s23p63d54s2
D. 1s22s22p63s23p63d104s24p3
Đáp án: A
Nguyên tố X có electron lớp ngoài cùng thuộc lớp N → X có 4 lớp
Nguyên tố X thuộc loại nguyên tố d, nguyên tử X có 5 electron hoá trị → tổng số e phân lớp sát ngoài cùng và lớp ngoài cùng là 5
Cấu hình của X là 1s22s22p63s23p63d34s2
Bài 10: Một nguyên tố thuộc khối các nguyên tố s haowcj p có 4 lớp electron, biết rằng lớp ngoài cùng có 4 electron. Nguyên tố này là
A. 27Ti B. 24Cr C. 32Ge D. 34Se
Đáp án: C
Nếu lớp ngoài cùng có 4e ⇒ Cấu hình electron lớp ngoài cùng là 4s24p2 .
⇒ Cấu hình electron nguyên tử của nguyên tố này là: 1s22s22p63s23p63d104s24p2 .
Nguyên tố 32Ge .
Bài 11: Cho hai nguyên tử của nguyên tố X và Y có số hiệu nguyên tử lần lượt là 12 và 28. Phát biểu nào sau đây là sai?
A. X và Y có cùng số electron ở lớp ngoài cùng.
B. X và Y cùng là các kim loại.
C. X và Y đều là các nguyên tố s.
D. Y có nhiều hơn X một lớp electron.
Đáp án: C
X là nguyên tố s, Y là nguyên tố d.
Bài 12: Nguyên tử nguyên tố X có tổng số hạt (proton, nowtron, electron) là 115, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 25 hạt. cấu hình electron lớp ngoài cùng của X là
A. 4s2
B. 4s24p5
C. 3s23p5
D. 3d104s1
Đáp án: B
Tính ra X có 35 electron trong nguyên tử.
Cấu hình nguyên tử của X là 1s22s22p63s23p63d104s24p5
Bài 13: Nguyên tử của nguyên tố X có tổng số electron trong các phân lớp p là 7. X là
A. Al
B. Mg
C. Si
D. Li
Đáp án: A
X có 2 phân lớp p và sự phân bố electron trên các phân lớp này là 2p6 và 3p1 (tổng số electron p là 7).
Cấu hình electron nguyên tử của X là: 1s22s22p63s23p63d14s1 X là Al.
Bài 14: Trong nguyên tử của nguyên tố X, phân lớp có năng lượng cao nhất là 3d1. Số hiệu nguyên tử của nguyên tố X là
A. 17.
B. 23.
C. 19.
D. 21.
Đáp án: D
Cấu hình electron nguyên tử của X là: 1s22s22p63s23p63d14s2 .
X có 21 electron trong nguyên tử.
Bài 15: Một nguyên tử X có 26 electron. Khi mất 2 electron, cấu hình electron của ion X2+ là
A. [Ar]3d44s2
B. [Ar]3d54s1
C. [Ar]3d6
D. [Ar]3d5
Đáp án: C
Khi mất electron, nguyên tử sẽ mất electron lần lượt từ phân lớp ngoài vào trong.