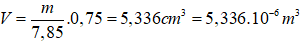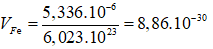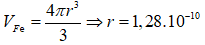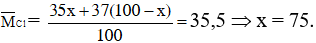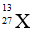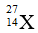Trắc nghiệm Hóa học 10 Bài 3 có đáp án năm 2021 - 2022
Bộ câu hỏi trắc nghiệm Hóa học lớp 10 có đáp án, chọn lọc năm 2021 – 2022 mới nhất gồm các câu hỏi trắc nghiệm đầy đủ các mức độ nhận biết, thông hiểu, vận dụng, vận dung cao. Hy vọng với tài liệu trắc nghiệm Hóa học lớp 10 sẽ giúp học sinh củng cố kiến thức, ôn tập và đạt điểm cao trong các bài thi trắc nghiệm môn Hóa học 10
Trắc nghiệm Hóa học 10 Bài 3: Luyện tập: Thành phần nguyên tử
Bài 1: Cho những nguyên tử của các nguyên tố sau:
Những nguyên tử nào sau đây là đồng vị của nhau ?
A. 1 và 2
B. 2 và 3
C. 1, 2 và 3
D. Cả 1, 2, 3, 4
Đáp án: C
Bài 2: Thực nghiệm chỉ ra rằng các nguyên tử bền có tỉ lệ số nơtron/số proton nằm trong khoảng 1 ≤ N/P ≤ 1,5 (trừ trường hợp nguyên tử H). Một nguyên tử X bền có tổng số hạt (proton, nơtron, electron) là 13. X là nguyên tử của nguyên tố nào sau đây?
A. liti
B. beri
C. cacbon
D. nitơ
Đáp án: B
Ta có: 2p + n =13
Mặt khác: vì 1,5p ≥ n ≥ p ⇒ 4,3 ≥ p ≥ 3,7 ⇒ p = 4.
Đó là nguyên tử của nguyên tố beri.
Bài 3: Hợp chất Z được tạo bởi hai nguyên tố X và Y có công thức XY2 trong đó Y chiếm 72,73% về khối lượng. Biết rằng trong phân tử Z, tổng số hạt (proton, nơtron, electron) là 66, số proton là 22. Nguyên tố Y là
A. cacbon.
B. oxi.
C. lưu huỳnh.
D. magie.
Đáp án: A
Gọi số hạt proton, nơtron của X là pX, nX ; số hạt proton, nơtron của Y là pY và nY.
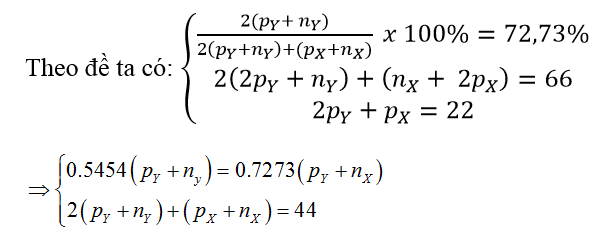
⇒ pY + nY = 16 và pX + nX = 12
Vậy: Y là oxi và X là cacbon.
Giá trị pY = nY = 8 và pX = nX = 6 thỏa mãn các phương trình.
Bài 4: Oxit X có công thức R2O. Tổng số hạt cơ bản (p, n, e) trong X là 92, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 28. X là chất nào dưới đây (biết rằng trong hạt nhân nguyên tử oxi có 8 proton và 8 nơtron) ?
A. N2O.
B. Na2O.
C. Cl2O.
D. K2O.
Đáp án: B
Tổng số hạt cơ bản (p, n, e) trong X là 92 → 2. (2pR + nR) + 2pO + nO = 92 → 2. (2pR + nR) = 68
Số hạt mang điện nhiều hơn số hạt không mang điện là 28 → (2.2pR + 2.nO ) - (2nR + nO) = 28
→ 4pR - 2nR = 20
Giải hệ → pR = 11, nR = 12 → R là Na
Bài 5: Ở 20oC khối lượng riêng của Au là 19,32 g/cm3. Trong tinh thể Au, các nguyên tử Au là những hình cầu chiếm 75% thể tích toàn khối tinh thể, phần còn lại là các khe rỗng giữa các quả cầu. Khối lượng mol của Au là 196,97. Bán kính nguyên tử gần đúng của Au ở 20oC là:
A. 1,28.10-8 cm.
B. 1,44.10-8 cm.
C. 1,59.10-8 cm
D. 1,75.10-8 cm.
Đáp án: A
Giả sử trong 1 mol Fe.
Thể tích thực của Fe là:
Thể tích 1 nguyên tử Fe là:
Bán kính:

Bài 6: Tổng số proton, notron, electron trong nguyên tử của hai nguyên tố X và M lần lươt là 52 và 82. M và X tạo hơp chất MXa, trong phân tử của hơp chất đó tổng số pronton của các nguyên tử là 77. Xác định công thức của MXa. Biết trong X có tỉ lệ notron: proton ≤ 1,22.
A. FeCl3
B. AlCl3
C. FeBr3
D. AlBr3
Đáp án:
Kí hiệu số p, n, e trong nguyên tố X là Z, N, E
Theo đầu bài ta có: Z + N + E = 52 → 2Z + N = 52
Với những nguyên tố bền (trừ hidro): Z ≤ N ≤ 1,52 Z → 3Z ≤ 2Z + N ≤ 1,52Z + 2Z
→ 3Z ≤ 52 ≤ 3,52Z → 14,77 ≤ Z ≤ 17,33
Với Z = 15 → N = 22; tỉ lệ N : Z = 22 : 15 = 1,47 > 1,22 (loại)
Với Z = 16 → N = 20; tỉ lệ N : Z = 20 : 16 = 1,25 > 1,22 (loại)
Với Z = 17 → N = 18; tỉ lệ N : Z = 18 : 17 = 1,06. X là clo
Kí hiệu số p, n, e của M là Z’, N’, E’
Theo đầu bài ta có: 2Z’ + N’ = 82 → 3Z' < 82 < 3,52Z'
Ta có Z’ = 77 – 17a → 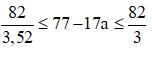
→ Z' = 77 - 17.3 = 26 → M là Fe.
Công thức thức của hợp chất là FeCl3.
Bài 7: Một loại khí clo có chứa 2 đồng vị 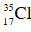
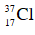
- Phần thứ nhất cho tác dụng vừa đủ với 125 ml dung dịch Ba(OH)2 0,88M.
- Phần thứ hai cho tác dụng với AgNO3 vừa đủ ta thu được 31,57 gam kết tủa.
Thành phần % số nguyên tử của đồng vị 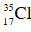
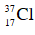
A. 75% và 25%
B. 25% và 75%
C. 30% và 70%
D. 70% và 30%
Đáp án: A
Gọi phần trăm số nguyên tử của 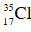
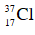
Cl2 + H2 → 2HCl (1)
Thí nghiệm 1: nBa(OH)2 = 0,88. 0,125 = 0,11 mol.
2HCl (0,22) + Ba(OH)2 (0,11 mol) → BaCl2 + 2H2O (2)
Thí nghiệm 2:
HCl + AgNO3 (0,22) → AgCl ↓ (0,22 mol) + HNO3 (3)
Vậy MAgCl = 108 + MCl = 31,57/0,22 = 143,5 → MCl = 143,5 – 108 = 35,5
Vậy thành phần phần trăm mỗi loại đồng vị của clo là : 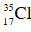
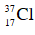
Bài 8: Nhận định nào sau đây không đúng
A. Tất cả các hạt nhân nguyên tử đều chứa proton và notron
B. Nguyên tử là hạt vô cùng nhỏ và trung hòa về điện
C. Vỏ electron mang điện tích âm và chuyển động xung quanh hạt nhân
D. Khối lượng nguyên tử tập trung ở hạt nhân
Đáp án: A
Bài 9: Nguyên tử X có chứa 13 hạt electron và 14 hạt nơtron . Kí hiệu của nguyên tử X là :
A. 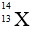
B.
C. 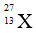
D.
Đáp án: C
Bài 10: Cho biết:
| Nguyên tố | Đồng vị | Khối lượng nguyên tử trung bình |
| Brom | 3579Br và 3581Br | 79,90 |
| Li | 36Li và 37Li | 6,94 |
Phát biểu nào sau đây là sai?
A. Hai đồng vị của Br có hàm lượng xấp xỉ bằng nhau.
B. Trong tự nhiên, liti tồn tại chủ yếu là đồng vị 37Li.
C. Có 4 loại phân tử LiBr trong tự nhiên với % phân tử xấp xỉ bằng nhau.
D. Phân tử khối của LiBr lớn nhất là 88.
Đáp án: C
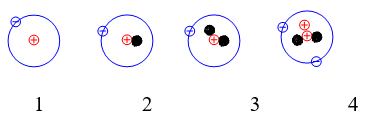
Bài 11: Hạt X và Y có cấu tạo như sau:
Phát biểu nào sau đây về X và Y là đúng?
A. X và Y là các đồng vị của cùng một nguyên tố hóa học.
B. X và Y là các hạt có điện tích trái dấu.
C. X và Y là các hạt mang điện tích âm.
D. X và Y là các hạt mang điện tích dương.
Đáp án: A
Hạt X và Y có cùng số proton và khác nhau về số nowtron.
Bài 12: Một nguyên tố X có 2 đồng vị là 127X và 131X.
Phát biểu nào sau đây là đúng?
A. 127X có ít hơn 131X 4 nơtron và 4 electron.
B. 127X có ít hơn 131X 4 nơtron.
C. 127X có ít hơn 131X 4 proton và 4 electron.
D. 127X có ít hơn 131X 4 proton.
Bài 13: Trong các phát biểu sau đây, phát biểu nào đúng?
A. Tôm-xơn (Thomson) đã đề xuất mô hình nguyên tử, trong đó hạt nhân chỉ chứa các hạt proton và nơtron.
B. Hạt nơtron không mang điện, nó được tạo thành bởi sự kết hợp một hạt proton và một hạt electron.
C. Khối lượng của electron bằng khoảng 1/2000 khối lượng của proton.
D. Đồng vị 131I của iot được sử dụng tron chẩn đoán và điều trị bệnh tuyến giáp.
Bài 14: Nguyên tử A có tổng số hạt mang điện và hạt không mang điện là 28, trong đó số hạt mang điện gấp 1,8 lần só hạt không mang điện. A là
A. 18Ar.
B. 10Ne.
C. 9F.
D. 8O.
Đáp án: C
Bài 15: Trong tự nhiên tìm được hai đồng vị của nguyên tố X. Khảo sát cho thấy cứ 100 nguyên tử của X thì có 73 nguyên tử 63X. Biết rằng nguyên tử khối trung bình của X là 63,546, số khối của đồng vị còn lại là
A. 64
B. 65
C. 66
D. 67
Đáp án: B
Đặt số khối của đồng vị còn lại là x.
Theo đề bài ta có: (73.63 + 27.x)/100 = 63,546 ⇒ x = 65